
����Ŀ����ͭ��CuFeS2������ͭ������Ҫ�����Ұ������ױ����Ϊ�ƽ��ֳ����˽�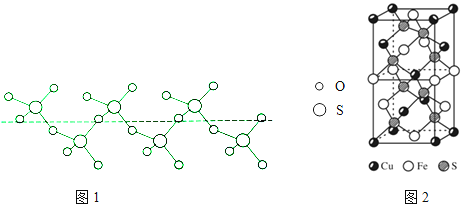
��1����ұ����ͭ��Ĺ����У�������Cu2O��Cu2S��Ӧ����Cu���ʣ���Ӧ�Ļ�ѧ����ʽ��
��2��Sλ�����ڱ��С� �壬����Ԫ���⻯���У�H2Te��H2S�е�ߵ�ԭ���� ��H2O��H2Te�е�ߵ�ԭ����
��3��S��+4��+6���ּ�̬��������ش��������⣺
�����й�����̬SO3��SO2��˵���У���ȷ���ǡ� ����
A������ԭ�ӵļ۲���Ӷ���Ŀ��� B�����Ǽ��Է���
C������ԭ�ӵŶԵ�����Ŀ��� D�������м��Լ�
�ڽ���Һ̬SO3��ȴ��289.8Kʱ���̵õ�һ������״�����ṹ�Ĺ��壬��ṹ��ͼ1���˹�̬SO3��Sԭ�ӵ��ӻ���������ǡ�
��4��Cu��+1��+2���ּ�̬�Ļ�����ش��������⣺
��Cu+�ļ۲�����Ų�Ϊ�� ����Cu2+�С� ����δ�ɶԵ��ӣ�
�����Ƶ�Cu��OH��2�ܹ��ܽ��ڹ���Ũ����Һ�У���Ӧ�����ӷ���ʽ�ǡ�
��5��CuFeS2�ľ�����ͼ2��ʾ����������a=0.524nm��c=1.032nm��CuFeS2�ľ�����ÿ��Cuԭ���롡 ����Sԭ����������ʽ���㾧���ܶ� ��=�� �� gcm��3 ��
���𰸡�
��1��2Cu2O+Cu2S![]() 6Cu+SO2��
6Cu+SO2��
��2����A�����߾�Ϊ���Ӿ����ҽṹ���ƣ�H2Te��Է���������H2S���Ӽ���������ǿ�����߾�Ϊ���Ӿ��壬H2O�����д������
��3��AD��sp3
��4��3d10��1��Cu��OH��2+2OH��=[Cu��OH��4]2����4��![]() ?
?
����������1��Cu2O��Cu2S��Ӧ����Cu���ʣ������ɶ�������ӦΪ2Cu2O+Cu2S![]() 6Cu+SO2�������Դ��ǣ�2Cu2O+Cu2S
6Cu+SO2�������Դ��ǣ�2Cu2O+Cu2S![]() 6Cu+SO2����
6Cu+SO2����
��2��S��ԭ�ӽṹ��3�����Ӳ㣬����������Ϊ6��λ�ڵڢ�A�壬H2Te��H2S����Է���������ķе�ߣ���H2Te�е�ߣ�H2O��H2Te�е�ߵ�ԭ�������߾�Ϊ���Ӿ��壬H2O�����д��������
���Դ��ǣ���A�����߾�Ϊ���Ӿ����ҽṹ���ƣ�H2Te��Է���������H2S���Ӽ���������ǿ�����߾�Ϊ���Ӿ��壬H2O�����д��������
��3����SO3�м۵��Ӷ�Ϊ3��û�й¶Ե��ӣ�Ϊƽ�������Σ���SO2�м۵�����Ϊ3���¶Ե�����Ϊ1��ΪV�ͣ���
A������ԭ�ӵļ۲���Ӷ���Ŀ��ȣ���A��ȷ��
B�����������ǷǼ��Է��ӣ���B����
C������ԭ�ӵŶԵ�����Ŀ���ȣ���C����
D��������S��O֮��ļ��Լ�����D��ȷ��
���Դ��ǣ�AD��
��ͼ1�й�̬SO3��Sԭ���γ�4�����۵��������ӻ����������sp3 �� ���Դ��ǣ�sp3��
��4����Cu��ԭ������Ϊ29���۵���Ϊ3d104s1 �� Cu+�ļ۲�����Ų�Ϊ3d10 �� Cu2+��3d�������9�����ӣ�ֻ��1�������ӣ����Դ��ǣ�3d10��1��
�����Ƶ�Cu��OH��2�ܹ��ܽ��ڹ���Ũ����Һ�����������ӣ���Ӧ�����ӷ���ʽ��ΪCu��OH��2+2OH��=[Cu��OH��4]2�� �� ���Դ��ǣ�Cu��OH��2+2OH��=[Cu��OH��4]2����
��5����������Cu��2��S������������ÿ��Cuԭ����4��S������8��S�������ڣ��ɻ�ѧʽΪCuFeS2 �� ��������Ϊ![]() �� ��������a=0.524nm��c=1.032nm�����Ϊ��0.524��10��7cm��2��1.032��10��7cm����=
�� ��������a=0.524nm��c=1.032nm�������0.524��10��7cm��2��1.032��10��7cm����=![]() =
=![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�4��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʶ�ˮ�ĵ������������õ��ǣ� ��
A.HCl
B.NH4Cl
C.CH3COONa
D.NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2+��Fe3+��O22����CN����F�����л����ӵ��γɵĻ�������й㷺��Ӧ�ã� 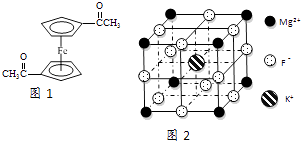
��1��C��N��Oԭ�ӵĵ�һ�������ɴ�С��˳����
��2��Fe2+��̬��������Ų�ʽΪ ��
��3����������ï���dz������Ϳ��������ṹ��ͼ1��ʾ����������̼ԭ�ӵ��ӻ���ʽ�� ��
��4�������K3Fe��CN��6�����ڵ��Ӵ������������������廥Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ �� ��֪��CN��2��ֱ���ͷ��ӣ������жԳ��ԣ���CN��2�Цм��ͦҼ��ĸ�����Ϊ ��
��5��F����������Fe3+�γ�[FeF6]3�� �� ��������Mg2+��K+�γ�һ��������ϵ�����Ӿ��壬�˾���Ӧ���ڼ������ṹ��ͼ2��ʾ���þ���Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ�ĸ�����������
A. ��ɢϵ�Ƿ�����ɫ B. ��ɢ�������Ƿ�����
C. �Ƿ��ܷ������������ D. ��ɢ�����ӵĴ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���Ϊͬ���칹����ǣ� ��
A.ʯī����ϩ
B.H2O��H2O2
C.1H �� 2H
D.�Ҵ��Ͷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ħ��������������Ӧ���У���ȷ���ǣ� ��
A.1mol OH-������Ϊ17g/mol
B.������̼��Ħ������Ϊ44g
C.��ԭ�ӵ�Ħ�����������������ԭ������
D.һ����ԭ�ӵ���������23/(6.02��1023)g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㡣һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����й��ڸõ�ص�������ȷ����
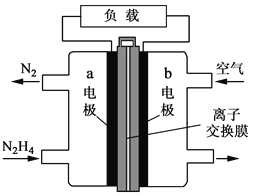
A. b������������Ӧ
B. a���ķ�Ӧʽ��N2H4��4OH����4e����N2����4H2O
C. �ŵ�ʱ��������a��������������b��
D. ���е����ӽ���Ĥ��ѡ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ���뽺��֪ʶ�ص��ǣ� ��
A. �����з�ɢ�����ӵ�ֱ��������Һ�з�ɢ�ʵ�����ֱ��
B. �͵��Ȼ�����Һ�м�������������Һ�õ����ɫ����
C. �ƺ��뺣�ڴ��γ�������
D. ���������ܽ���ϡ�����������Ⱦ����ж��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС��Ϊ̽������Ũ���ᷴӦ�������ͼ1��ͼ2��ʾװ�ý���ʵ�顣 
��1���Ƚ���ʵ��װ�ã�ͼ2��ʾװ�õ��ŵ��ǣ� ���ܸ��õ������ж�����SO2 �� ��ֹ����Ⱦ������
����
��2����˵����SO2���������ʵ��������?
��3����Ӧһ��ʱ����õι���ȡA�Թ��е���Һ��������ˮ��Ϊ�����������������������ӵijɷ����������ֿ��ܣ� ��ֻ����Fe3������ֻ����Fe2��������Fe3������Fe2����
Ϊ��֤��Ŀ����ԣ�ѡ�������Լ�����д���пհף�
A��ϡ������Һ B��ϡ������Һ
C��KSCN��Һ D��KMnO4��Һ
E��NaOH��Һ F������KI��Һ
G��H2O2��Һ
��֤��ȡ�������ȵμ�������(���Լ���ţ���ͬ)�����ٵμ������� �� ������Һ��ɫ�ı仯��ȷ��������Ƿ���ȷ��
��֤����1.ȡ�������μ�������(���Լ����)����Һ����ɫ��ɫ�������к���Fe3�� �� ������Ӧ�����ӷ���ʽΪ��
����2.��ȡ�����������μӵ�������(���Լ����)����Һ����ɫ��Ϊɫ���������к���Fe2����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com