
【题目】25℃时,0.1mol/L的HA溶液中 ![]() =1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
=1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是(填“强电解质”或“弱电解质”,下同),BOH是 .
(2)HA的电离方程式是 . 其中由水电离出的c(H+)=mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是(填字母).
A.![]()
B.![]()
C.c(H+)与c(OH﹣)的乘积
D.c(OH﹣)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈性,请用离子方程式解释其原因 , 混合溶液中各离子浓度由大到小的顺序是 .
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11.(混合溶液体积变化忽略不计),应加 NaHSO4mL(保留到小数点后一位)
【答案】
(1)弱电解质;强电解质
(2)HA?H++A﹣;10﹣12
(3)B
(4)碱;A﹣+H2O?HA+OH﹣;c(B+)>c(A﹣)>c(OH﹣)>c(H+)
(5)8.18
【解析】解:(1)25℃时,0.1mol/L的HA溶液中 ![]() =1010、c(OH﹣).c(H+)=10﹣14 , 则该溶液中c(H+)=0.01mol/<0.1mol/L,所以HA是弱酸,则HA是弱电解质; 0.01mol/L的BOH溶液pH=12,该溶液中c(OH﹣)=
=1010、c(OH﹣).c(H+)=10﹣14 , 则该溶液中c(H+)=0.01mol/<0.1mol/L,所以HA是弱酸,则HA是弱电解质; 0.01mol/L的BOH溶液pH=12,该溶液中c(OH﹣)= ![]() mol/L=0.01mol/L=c(BOH),所以BOH是强碱,则BH是强电解质;
mol/L=0.01mol/L=c(BOH),所以BOH是强碱,则BH是强电解质;
所以答案是:弱电解质;强电解质; (2)HA是弱酸,在水溶液中存在电离平衡,电离方程式为HAH++A﹣;该溶液中水电离出的c(H+)=c(OH﹣)= ![]() mol/L=10﹣12 mol/L,
mol/L=10﹣12 mol/L,
所以答案是:HAH++A﹣;10﹣12; (3)加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A﹣)减小,溶液温度不变,离子积常数不变,则溶液中c(OH﹣)增大;
A.加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以 ![]() 增大,故错误;
增大,故错误;
B.加水稀释促进HA电离,n(A﹣)增大、n(HA)减小,溶液体积相同,所以 ![]() 减小,故正确;
减小,故正确;
C.温度不变,水的离子积常数不变,所以c(H+)与c(OH﹣)的乘积不变,故错误;
D.加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液温度不变,离子积常数不变,则溶液中c(OH﹣)增大,故错误;
故选B;(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合,二者恰好反应生成BA,BA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,则c(OH﹣)>c(H+),但其水解程度较小,结合电荷守恒得c(B+)>c(A﹣),所以离子浓度大小顺序是c(B+)>c(A﹣)>c(OH﹣)>c(H+),其水解方程式为 A﹣+H2OHA+OH﹣ , 所以答案是:碱性; A﹣+H2OHA+OH﹣;c(B+)>c(A﹣)>c(OH﹣)>c(H+);(5)常温下pH=12的BOH溶液中c(OH﹣)= ![]() mol/L=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液中
mol/L=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液中 ![]() mol/L=0.001mol/L,则混合溶液呈碱性,混合溶液中c(OH﹣)=
mol/L=0.001mol/L,则混合溶液呈碱性,混合溶液中c(OH﹣)= ![]() =0.001mol/L,x=81.8mL,
=0.001mol/L,x=81.8mL,
所以答案是:81.8.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】某学生配制100mL 1mol/L的硫酸溶液,进行下列操作,然后对溶液浓度作精确测定,发现真实浓度小于1mol/L。他的下列操作中使浓度偏低的原因是 ( )
①用量筒取浓硫酸时,俯视读数;②量筒中浓硫酸全部转移到烧杯中稀释,再转移到100mL容量瓶中,烧杯未洗涤;③用玻璃棒引流将烧杯中溶液转移至容量瓶中,有溶液流到了容量瓶外面;④用胶头滴管加蒸馏水时,不是逐滴加入,因而使液面超过了刻度线,他立即用滴管吸去多余的水,使溶液凹面刚好和刻度线相切。
A. ②③④ B. ③④
C. ①②③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤是一种常用的燃料。由于煤燃烧产生的废气中含有SO2、NO2和NO等多种有害气体和烟尘,会对环境造成污染,因此需要对煤进行加工后再燃烧,或将废气净化后再排放。
(1)将煤直接进行燃烧可能会形成硝酸型酸雨。
①写出有关物质转化为硝酸的化学方程式_________________。
②以下是对硝酸型酸雨的评价,其中正确的是________(用序号填空)。
a.杀死水中的浮游生物,减少鱼类食物来源,破坏水生生态系统
b.对电线、铁轨、桥梁、房屋等均会造成严重损害
c.破坏臭氧层,导致臭氧空洞
d.硝酸与土壤中的矿物质发生作用转化为硝酸盐,给植物提供氮肥
(2)如图是对煤燃烧产生的废气进行常温脱硫处理的基本流程示意图,试写出在废气脱硫并形成副产物的过程中所发生的主要化学反应的化学方程式_______________。
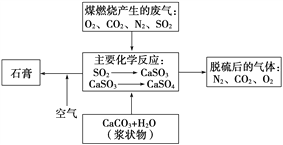
(3)脱硫以后,在废气中含量明显增加的不良气体是(写物质名称)________,它对环境的负面影响是___________________________________________。
(4)检验脱硫后废气中是否含有SO2的简单方法是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.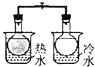 将NO2球浸泡在冷水和热水中
将NO2球浸泡在冷水和热水中
B.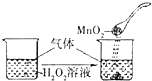 向H2O2溶液中滴加MnO2粉末
向H2O2溶液中滴加MnO2粉末
C.
T(℃) | 25 | 50 | 100 |
水的离子积常数KW(×10﹣14) | 1.01 | 5.47 | 55.0 |
D.
c(氨水)/mol.L﹣1 | 0.1 | 0.01 |
pH | 11.1 | 10.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2+、Fe3+与O22﹣、CN﹣、F﹣、有机分子等形成的化合物具有广泛的应用. 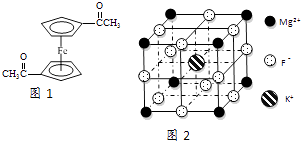
(1)C、N、O原子的第一电离能由大到小的顺序是
(2)Fe2+基态核外电子排布式为 .
(3)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示.此物质中碳原子的杂化方式是 .
(4)配合物K3Fe(CN)6可用于电子传感器的制作.与配体互为等电子体的一种分子的化学式为 . 已知(CN)2是直线型分子,并具有对称性,则(CN)2中π键和σ键的个数比为 .
(5)F﹣不仅可与Fe3+形成[FeF6]3﹣ , 还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示.该晶体的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项与胶体知识无关的是( )
A. 胶体中分散质粒子的直径大于溶液中分散质的粒子直径
B. 向饱和的氯化铁溶液中加入氢氧化钠溶液得到红褐色沉淀
C. 黄河入海口处形成三角洲
D. 氢氧化铁溶胶、稀豆浆、云雾等均具有丁达尔现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com