
分析 (1)向氨水中加入MgCl2固体时,镁离子与氢氧根离子反应生成氢氧化镁沉淀,使平衡向右移动,促进一水合氨电离,据此分析离子浓度变化;
(2)向氨水中加入浓盐酸,氢离子与氢氧根离子反应生成水,使平衡向右移动,促进一水合氨电离,据此分析离子浓度变化;
解答 解:(1)向氨水中加入氯化镁固体时,镁离子和氢氧根离子反应生成氢氧化镁沉淀,氢氧根离子浓度减小,促进一水合氨电离,则溶液中铵根离子浓度增大,
故答案为:右;减小;增大;
(2)向氨水中加入浓盐酸时,氢离子会消耗氢氧根离子,氢氧根离子浓度减小,一水合氨的电离平衡向右移动,NH3、NH3•H2O的浓度均减小,
故答案为:右;OH-、NH3、NH3•H2O.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,再结合溶液中离子浓度变化确定平衡移动方向,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率加快 | |
| B. | 提高起始的反应温度,正反应速率加快,逆反应速率减慢,平衡正向移动 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol Ne,反应速率加快,平衡正向移动 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
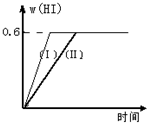 Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
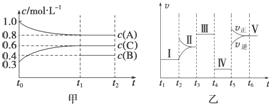 向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.
向某密闭容器中加入 4mol A、1.2mol C 和一定量的 B 三种气体,一定条件 下发生反应,各物质的浓度随时间变化如甲图所示[已知 t0~t1 阶段保持恒温、恒容,且 c(B)未画出].乙图为 t2 时刻后改变反应条件,反应速率随时间的变化情况,已知 在 t2、t3、t4、t5 时刻各改变一种不同的条件,其中 t3 时刻为使用催化剂.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0、△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+达到平衡后,升高温度平衡逆向移动 | |
| C. | AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3 | |
| D. | 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | 该装置将化学能转化为光能和电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com