
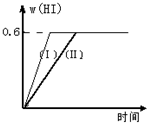
 ��1mol I2��g����2mol H2����2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g������H��0������ƽ�⣮HI���������w��HI����ʱ��仯��ͼ���ߣ�����ʾ��
��1mol I2��g����2mol H2����2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g������H��0������ƽ�⣮HI���������w��HI����ʱ��仯��ͼ���ߣ�����ʾ������ ��1�����ݵ⻯��������������ƽ��ʱ�⻯������ʵ������ٸ��ݵ⻯�������֮��Ĺ�ϵʽ���������ķ�Ӧ���ʣ�
��2����Ӧʱ�䷢���仯�����⻯��ĺ������䣬˵��������ֻ�ı䷴Ӧ���ʲ�Ӱ��ƽ�⣬ѹǿ�ʹ����Ը÷�Ӧƽ����Ӱ�죻
��3�����õ�Чƽ���жϣ����º��ݣ�ǰ������������仯������ѧ������ת������ߣ�������ԭ������ķ�Ӧ�����ʵ���������ȼ��ɣ�
��� �⣺��1���÷�Ӧ��һ����Ӧǰ�������������Ļ�ѧ��Ӧ�����Է�Ӧ������������ʵ�����3mol��ͬһ�����и����������������������ʵ�������������ƽ��ʱ�⻯������ʵ���=3mol��0.6=1.8mol����μӷ�Ӧ��n��H2��=0.5n��HI��=0.5��1.8=0.9mol��
��H2��ʾ�ķ�Ӧ����Ϊ$\frac{\frac{0.9mol}{2L}}{5min}$=0.09 mol•L-1min-1��
�ʴ�Ϊ��0.09 mol•L-1min-1��
��2���ڼ�������w��HI���ı仯�����ߣ��� ��ʾ����Ӧʱ�����̣��⻯��ĺ������䣬˵��������ֻ�����˷�Ӧ���ʲ�Ӱ��ƽ�⣬����ѹǿ����С��Ӧ����������ͼ�������Ը÷�Ӧƽ����Ӱ�죬��������Ӧ���ʣ����̷�Ӧʱ�䣻
�ʴ�Ϊ���ۢݣ�
��4���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���a mol I2��g����b mol H2��g����c mol HI��a��b��c������0����������Ӧ����ƽ��ʱ��HI�����������Ϊ0.6����ԭ����ƽ���ǵ�Чƽ�⣬���º��ݣ�ǰ������������仯������ѧ������ת������ߣ�������ԭ������ķ�Ӧ�����ʵ���������ȼ��ɣ�
I2��g��+H2��g��?2HI��g����
��ʼ��mol����a b c
�仯��mol����0.5c 0.5c c
ƽ�⣨mol����a+0.5c b+0.5c 0
��a+0.5c ������ b+0.5c��=1��2��
����4a+c=2b��
�ʴ�Ϊ��4a+c=2b��
���� ���⿼����������Ի�ѧƽ���Ӱ�죬��Чƽ���֪ʶ�㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע���������ķ�Ӧ�ص㼰��Чƽ���Ӧ�ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����б�״����V L������ȫ��Ӧ����ת��n�����ӣ����ӵ�������NA���ɱ�ʾΪ$\frac{22.4n}{5V}$��д������ĸ�ı���ʽ����
�����б�״����V L������ȫ��Ӧ����ת��n�����ӣ����ӵ�������NA���ɱ�ʾΪ$\frac{22.4n}{5V}$��д������ĸ�ı���ʽ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��101 kPaʱ��1 mol������ȫȼ��ʱ���ų������������������ʵ�ȼ���� | |
| B�� | ��ͼ���кͷ�Ӧ����1 molˮ����ʱ�ķ�Ӧ�Ƚ��к��� | |
| C�� | ȼ���Ⱥ��к����Ƿ�Ӧ�ȵ�����֮һ | |
| D�� | ��ϡ��Һ�У�1 mol�����1 mol����������ȫ�к�ʱ�ų�������Ϊ57.3 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ��ѧʽ | ��ɫ | Ksp |
| AgCl | ��ɫ | 2.0��10-10 |
| AgBr | dz��ɫ | 5.4��10-13 |
| AgI | ��ɫ | 8.3��10-17 |
| Ag2S | ��ɫ | 2.0��10-48 |
| Ag2CrO4 | ��ɫ | 2.0��10-12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H2����H3����H1 | B�� | ��H3����H2����H1 | C�� | ��H3����H1����H2 | D�� | ��H1����H2����H3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
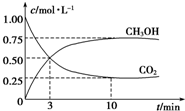 Ϊ̽����CO2������ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2��3molH2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1��T�¶��£����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ����ش��������⣺
Ϊ̽����CO2������ȼ�ϼ״��ķ�Ӧԭ�����ֽ�������ʵ�飺�����Ϊ1L���ܱ������У�����1mol CO2��3molH2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H=-49.0kJ•mol-1��T�¶��£����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ����ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ױ���ʹ����KMnO4��Һ��ɫ�������ͼ��鲻�� | |
| B�� | �����ܸ�NaOH��Һ��Ӧ���Ҵ����� | |
| C�� | ��ϩ�ܷ����ӳɷ�Ӧ�����鲻�� | |
| D�� | ����50-60��ʱ����������Ӧ���������������ױ���30��ʱ���ɷ���������Ӧ�����������ױ� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com