
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)△H=-115.6 kJ·mol-1,可实现氯的循环利用。已知:
2Cl2(g)+2H2O(g)△H=-115.6 kJ·mol-1,可实现氯的循环利用。已知:
下列说法正确的是
A.升高温度能提高HCl的转化率
B.断裂H2O(g)中l mol H—O键比断裂HCl(g)中l mol H—Cl键所需的能量高
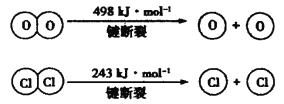
C.1 mol Cl2(g)转化为2 mol Cl放出243 kJ能量
D.加入催化剂,能使该反应的焓变减小
【答案】B
【解析】
A、焓变为负,为放热反应,升高温度平衡逆向移动;
B、焓变等于断裂化学键吸收的能量减去成键释放的能量;
C、断裂化学键吸收能量;
D、催化剂不改变反应的始终态。
A、焓变为负,为放热反应,升高温度平衡逆向移动,则HCl的转化率减小,故A错误;
B、焓变等于断裂化学键吸收的能量减去成键释放的能量,则4×E(H- C1) + 498k/mol一2×243kJ/mol-4 E(H- O)= -115.6kJ/mol,可知4× E(H- CI)--4×E(H-O)= - 127.6kJ/ mol,断裂H2O(g)中1molH- O键比断裂HCl(g)中1molH- Cl键所需能量高,故B正确;
C、断裂化学键吸收能量,则1molCl2转化为2molCl原子吸收243kJ热量,故C错误;
D、催化剂不改变反应的始终态,则加催化剂,焓变不变,故D错误;
故选B。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户。用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )

A.放电时,甲电极为正极,OH-移向乙电极
B.放电时,乙电极反应为:Ni(OH)2+OH-—e-=NiO(OH)+H2O
C.充电时,电池的碳电极与直流电源的正极相连
D.电池总反应为H2+2NiOOH![]() 2Ni(OH)2
2Ni(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是

A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g)=CH3OH(l) △H=x
(1)己知常温下CH3OH、H2和CO的燃烧热分別为726.5kl/mo1、285.5kJ/mol、283.0kJ/mol,則x=_______;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应(CH3OH为气体),相关数据如图。

①该反应0-10min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是______(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为_______。相同条件下,若起始投料加倍,达平衡时,CO的体积分数将________(填“增大”、“减小”或“不变”)
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)表示平衡常数(以Kp表示),其中,PB=P总×B的体积分数;若在TK下平衡气体总压强xatm,则该反应Kp=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图,请分析lnK随T呈现上述变化趋势的原因是:____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
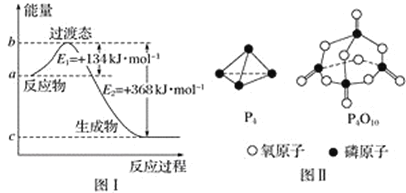
(1)图Ⅰ是 1mol NO2(g)和 1 mol CO(g)反应生成 CO2 和NO 过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是_____(填“增大”“减小”或“不变”,下同),ΔH 的变化是_____。请写出 NO2和 CO反应的热化学方程式:_____。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则甲醇燃烧生成液态水的热化学方程式:_____。
(3)下表是部分化学键的键能数据:
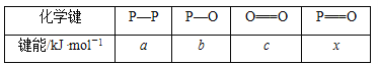
已知 1 mol 白磷(P4)完全燃烧放热为 dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中 x=_____kJ·mol-1(用含有 a、b、c、d 的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NaOH和NaHCO3的混合物X放在密闭容器中加热,充分反应后生成V1 L气体Z(V1≠0)。反应后的固体残渣Y与过量的稀盐酸反应,又生成V2 L气体Z(V1、V2均为标准状况下气体的体积)。下列判断错误的是( )
A. Y的成分为Na2CO3
B. Z的成分为CO2
C. V1>V2
D. X中n(Na+)=![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烃是一类重要的有机化合物,其结构与性质密切相关。
①下列有机化合物与甲烷互为同系物的是______(填字母)。
a.乙烯 b.乙烷 c.乙炔
②下列试剂可用于鉴别乙烷和乙烯的是______(填字母)。
a.水 b.四氯化碳 c.酸性KMnO4溶液
③下列有机化合物易溶于水的是________。
a..苯 b.乙烷 c.乙醇
(2) CH2=CH2、![]() 、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
①能通过化学反应使溴水褪色的是____________。
②能发生水解反应的是____________。
③能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是____________。
④能与Na2CO3溶液反应有气体生成的是__________。
(3)以淀粉为主要原料合成一种具有果香味的物质C合成路线如图所示。
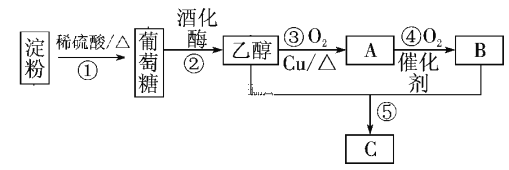
请回答下列问题:
(i) A的结构简式为____________,B分子中的官能团名称为________。
(ii)上述①~⑤的反应中,属于取代反应的有___________。(填序号)
(iii) 写出下列转化的化学方程式:
反应①____________________________;
反应⑤___________________________;
(4)乙烯是石油化工的重要基础原料,工业上可由乙烯与水反应制乙醇,该反应类型为_______,其化学方程式为___________________;乙烯还可通过加聚反应获得高分子材料聚乙烯,化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法中不正确的是( )
A.1 mol OH含8 NA个电子
B.1 mol CH4和CO2混合气体中含C原子数为NA
C.常温常压下,48 g O3含有的氧原子数为3NA
D.标准状况下,64 g SO2中含有的原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com