
【题目】下列各图叙述正确的是![]()
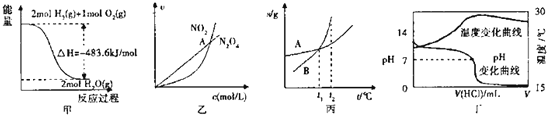
A.甲表示![]() 与
与![]() 发生反应过程中的能量变化,
发生反应过程中的能量变化,![]() 的燃烧热为
的燃烧热为![]()
B.乙表示恒温恒容条件下反应![]() 中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
中,各物质的浓度与其速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将![]() 时A、B的饱和溶液分别升温至
时A、B的饱和溶液分别升温至![]() 时,溶质的质量分数
时,溶质的质量分数![]()
D.丁表示室温下,将![]() 盐酸滴入
盐酸滴入![]()
![]() 氨水中,溶液pH和温度随加入盐酸体积变化曲线
氨水中,溶液pH和温度随加入盐酸体积变化曲线
【答案】D
【解析】
A.图象中1mol氢气完全燃烧生成的是水蒸气时放热![]() ,不是氢气的燃烧热,故A错误;
,不是氢气的燃烧热,故A错误;
B.交点A对应的状态是二氧化氮和四氧化二氮表示的反应速率相同,不能证明反应达到平衡,故B错误;
C.A、B两物质的溶解度随温度变化情况,![]() 时,AB溶解度相同,A、B的饱和溶液质量分数相同,分别升温至
时,AB溶解度相同,A、B的饱和溶液质量分数相同,分别升温至![]() 时,溶解度增大,但溶液浓度不变溶质的质量分数
时,溶解度增大,但溶液浓度不变溶质的质量分数![]() ,故C错误;
,故C错误;
D.盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因;![]() 溶液呈中性,则
溶液呈中性,则![]() ,根据电荷守恒可知
,根据电荷守恒可知![]() ,随着盐酸滴入发生中和反应,恰好反应生成氯化铵溶液水解呈酸性,图象符合反应过程中浓度变化,温度变化,故D正确;
,随着盐酸滴入发生中和反应,恰好反应生成氯化铵溶液水解呈酸性,图象符合反应过程中浓度变化,温度变化,故D正确;
故选:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于反应与能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,E反应物<E生成物
B.CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物<E生成物
C.2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJmol-1,1molHCl在密闭容器中分解后放出92.3kJ的能量
D.将0.5molN2和1.5molH2置于密闭的容器中充分反应后生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,AG的定义为AG=lg![]() 。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
。室温下实验室中用0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定过程如图所示,下列叙述正确的是
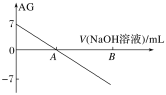
A.室温下,醋酸的电离常数约为10-5
B.A点时加入氢氧化钠溶液的体积为20.00 mL
C.若B点为40 mL,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
D.从A到B,水的电离程度逐渐变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时, Ksp (AgCl)= 1.56×10-10, Ksp(Ag2CrO4)= 9.0×10-12,下列说法正确的是
A. AgCl 和 Ag2CrO4 共存的悬浊液中,![]()
B. 向Ag2CrO4悬浊液中加入 NaCl 浓溶液, Ag2CrO4不可能转化为 AgCl
C. 向 AgCl 饱和溶液中加入 NaCl 晶体, 有 AgC1 析出且溶液中 c(Cl-)=c(Ag+)
D. 向同浓度的 Na2CrO4和 NaCl 混合溶液中滴加 AgNO3溶液,AgC1先析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏加德罗常数的值,下列说法中正确的
表示阿伏加德罗常数的值,下列说法中正确的
![]() 一定条件下定容容器中充入
一定条件下定容容器中充入![]() 和
和![]() 发生反应:3
发生反应:3![]() ;
;![]() ,当该反应放出
,当该反应放出![]() 的热量时,容器中的氢分子数共有
的热量时,容器中的氢分子数共有![]()
![]() 常温下,
常温下,![]() 和
和![]() 的混合物中含有的碳原子数为
的混合物中含有的碳原子数为![]()
![]() 硫酸钠固体中含有
硫酸钠固体中含有![]() 个硫酸钠分子;
个硫酸钠分子;
![]() 中含有的质子数、中子数、电子数均为
中含有的质子数、中子数、电子数均为![]()
![]() 标准状况下,
标准状况下,![]() 氯仿中含有
氯仿中含有![]() 键的数目为
键的数目为![]()
![]() 将
将![]() 的
的![]() 溶液滴入沸水中可制得
溶液滴入沸水中可制得![]() 胶粒
胶粒![]() .
.
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氮的变化关系图如下:
![]()
则下列说法不正确的是( )
A.路线①②③是工业生产硝酸的主要途径
B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径
C.上述所有反应都是氧化还原反应
D.上述反应中只有③属于氮的固定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
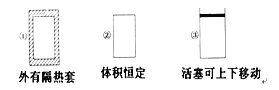
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
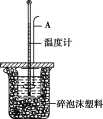
(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】久置的FeSO4溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某硏究小组为硏究溶液中Fe2+被O2氧化的过程,查阅资料发现:溶液中Fe2+的氧化过程分为先后两步,首先是Fe2+水解,接着水解产物被O2氧化。于是小组同学决定研究常温下不同pH对Fe2+被O2氧化的影响,并测定了Fe2+氧化率随时间变化的关系,结果如图。
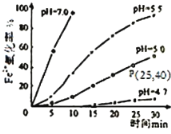
回答下列问题:
(1)写出Fe2+水解的离子方程式___;要抑制FeSO4水解,可以采取的措施是___。
(2)若配制的FeSO4溶液浓度为0.01mol/L,反应过程中溶液体积不变,计算图中P点Fe2+的氧化速率___。
(3)在酸性条件下,Fe2+被O2氧化的反应方程式为:4Fe2++O2+4H+![]() 4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
4Fe3++2H2O,已知常温下该反应的平衡常数很大。则下列说法正确的是___。
a.Fe2+转化为Fe3+的趋势很大
b.Fe2+转化为Fe3+的速率很大
c.该反应进行得很完全
d.酸性条件下Fe2+不会被氧化
(4)结合图分析不同pH对Fe2+被O2氧化的反应产生了怎样的影响___。
(5)用K2Cr2O7标准溶液測定溶液中Fe2+浓度,从而计算Fe2+的氧化率。反应如下:6Fe2++Cr2O72-+14H+→2Cr3++6Fe3++7H2O,若取20mL待测溶液,用0.0200mol·L1K2Cr2O7标准溶液滴定,消耗标准溶液16.50mL,则溶液中c(Fe2+)=___mol·L1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com