
����Ŀ������AG��ʾ��Һ����ȣ�AG�Ķ���ΪAG=lg![]() ��������ʵ��������0.01 mol��L��1������������Һ�ζ�20.00 mL 0.01 mol��L-1���ᣬ�ζ�������ͼ��ʾ������������ȷ����
��������ʵ��������0.01 mol��L��1������������Һ�ζ�20.00 mL 0.01 mol��L-1���ᣬ�ζ�������ͼ��ʾ������������ȷ����
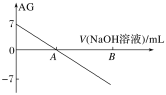
A.�����£�����ĵ��볣��ԼΪ10��5
B.A��ʱ��������������Һ�����Ϊ20.00 mL
C.��B��Ϊ40 mL��������Һ�У�c(Na+)=c(CH3COO-)+c(CH3COOH)
D.��A��B��ˮ�ĵ���̶����
���𰸡�A
��������
A.����ͼ���֪���������£�������Һ��AG=lg![]() =7����
=7����![]() =107����ˮ�����ӻ�Kw=c(H��)��c(OH-)=10-14����ʽ������֪��c(H��)=10��3..5 mol/L�����ڴ�����Һ�У�c(CH3COO-)��c(H��)=10��3.5 mol/L����˴���ĵ���ƽ�ⳣ��Ka=
=107����ˮ�����ӻ�Kw=c(H��)��c(OH-)=10-14����ʽ������֪��c(H��)=10��3..5 mol/L�����ڴ�����Һ�У�c(CH3COO-)��c(H��)=10��3.5 mol/L����˴���ĵ���ƽ�ⳣ��Ka=![]() ��
��![]() =10-5��A��ȷ��
=10-5��A��ȷ��
B.A���AG=lg![]() =0����
=0����![]() =1����c(H��)=c(OH-)����ʱ��Һ�����ԣ�������������������Һ20.00 mLʱ���������ƺʹ���ǡ����ȫ�кͣ��õ���������Һ����������ǿ�������Σ�CH3COO-ˮ��ʹ��Һ�Լ��ԣ�˵��A��ʱ��������������Һ�����С��20.00 mL��B����
=1����c(H��)=c(OH-)����ʱ��Һ�����ԣ�������������������Һ20.00 mLʱ���������ƺʹ���ǡ����ȫ�кͣ��õ���������Һ����������ǿ�������Σ�CH3COO-ˮ��ʹ��Һ�Լ��ԣ�˵��A��ʱ��������������Һ�����С��20.00 mL��B����
C.��B�����NaOH��Һ40 mLʱ��������ҺΪ��Ũ�ȵ�CH3COONa��NaOH�Ļ����Һ�����������غ��֪��c(Na+)=2[c(CH3COO-)+c(CH3COOH)]��C����
D.A��֮��V(NaOH)>20 mL��ˮ�ĵ����ܵ����ƣ�����̶��ֻ���С��D����
�ʺ���ѡ����A��


 Ӣ�żƻ���ĩ����ϵ�д�
Ӣ�żƻ���ĩ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǽ���Ԫ����Ȼ����࣬��������Ȼ���еķ��ȴ�ܴ���ش��������⣺
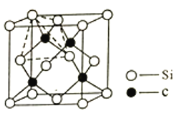
(1)BN(�����𣬾����ṹ��ͼ)��CO2�еĻ�ѧ����Ϊ���ۼ���BN���۵����Ӳ�ȴ�CO2�ľ���ɱ�ȴ�����Ҽ����������ɴ˿����жϣ�BN������______���壬CO2������______���壬BN ������Bԭ�ӵ��ӻ��������Ϊ______���ɱ���Cԭ�ӵ��ӻ��������Ϊ______

(2)���Ӽ��ԣ�OF2______H2O�����ǣ�OF2______H2O(��������������������)
(3)���ʯ��ʯī����̼Ԫ�صĵ��ʣ���ʯī�����۵�Ƚ��ʯ______��ԭ����______
(4)������Ľṹ����ʯ�ṹ���ƣ��������ʯ������һ���Cԭ�ӻ���Siԭ����ͬ��ԭ�Ӳ��ɼ��������ͼ��ʾ�Ľ��ɰ(SiC)�ṹ����SiC�ṹ�У�ÿ��Cԭ����Χ��������������Cԭ����ĿΪ______������C-Si����Ϊacm�����ܶ�Ϊ______g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼΪ�ɱ��ľ���ṹʾ��ͼ��
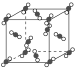
ͨ���۲������ÿ��CO2������Χ���ڵȾ����CO2������__������CO2���������ʵ㣬�辧���߳�Ϊapm������ڵ�����CO2���ӵľ���Ϊ__pm��
��2���ڱ������У�ˮ����֮�����Ҫ��������__������__�����ڸ���Ҫ�������빲�ۼ�һ������__�ԣ���1��ˮ������Χֻ��__�����ڵ�ˮ���ӣ���Щˮ����λ��__�Ķ��㡣�������з�ʽʹ��������ˮ���ӵĿռ�������__(�����ϸ��������ϵ���)���ʱ����ܶȱ�ˮ���ܶ�Ҫ__(������������С��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuCl)�ǰ�ɫ��ĩ������ˮ�����������²��ȶ��������ɽ��� Cu ��Cu2+���㷺Ӧ���ڻ�����ӡȾ����ҵ��ij�о���ѧϰС�����ȷֽ� CuC122H2O �Ʊ� CuCl�����������̽��������˵������ȷ����( )
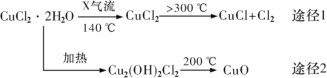
A.;�� 1 �в�����Cl2 ���Ի���ѭ������
B.;�� 2 �� 200��ʱ��Ӧ�Ļ�ѧ����ʽΪ��Cu2(OH)2Cl2![]() 2CuO+2HCl��
2CuO+2HCl��
C.X ������HCl��Ŀ�������� CuCl22H2O ���ȹ��̿��ܵ�ˮ��
D.CuCl ��ϡ���ᷴӦ�����ӷ���ʽΪ��2CuCl��4H+��SO42��=2Cu2+��2Cl����SO2����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������װ�÷���ʵ��Ҫ����ǣ���
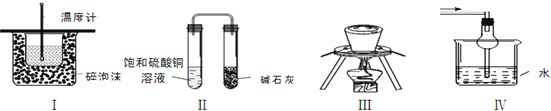
A.װ�â�����ڲⶨ�к���
B.װ�â�װ�÷���һ��ʱ�����![]() ��Һ�в�������ɫ����
��Һ�в�������ɫ����
C.װ�â��е�ʯӢ�����������ۻ���������
D.װ�â�����������������ˮ��β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�Ϊ2 L���ܱ�������ͨ���������巢����ѧ��Ӧ����Ӧ�и����ʵ����ʵ����仯��ͼ��ʾ���Ը÷�Ӧ���ƶϺ�������

A. �÷�Ӧ�Ļ�ѧ����ʽΪ6A��2 D![]() 3B��4C
3B��4C
B. ��Ӧ���е�1 sʱ��v(A)��v(B)
C. ��Ӧ���е�5 sʱ��B��ƽ����Ӧ����Ϊ0.06mol/(L��s)
D. ��Ӧ���е�5 sʱ��v(A)��v(B)��v(C)��v(D)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2L�ܱ�������X��Y��Z������̬���ʵ����ʵ���(n)��ʱ��(t)�仯��������ͼ��ʾ����ͼ������
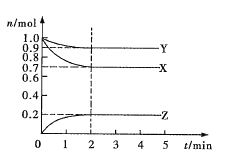
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ______________��
(2)��Ӧ��ʼ��2min����Z��ʾ��ƽ����Ӧ����Ϊ_________��
(3)����������˵��������Ӧ�ﵽ��ѧƽ��״̬����________(�����)
A.�������������ʵ�������ʱ��ı仯���仯
B.��������ѹǿ����ʱ��ı仯���仯
C.��λʱ����ÿ����![]() X��ͬʱ����
X��ͬʱ����![]() Z
Z
D.������������������ʱ��ı仯���仯
E.���������ܶȲ��ٷ����ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ͼ������ȷ����![]()
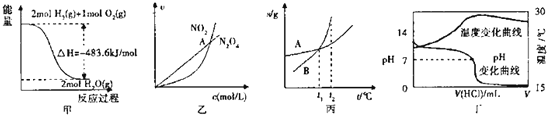
A.�ױ�ʾ![]() ��
��![]() ������Ӧ�����е������仯��
������Ӧ�����е������仯��![]() ��ȼ����Ϊ
��ȼ����Ϊ![]()
B.�ұ�ʾ���º��������·�Ӧ![]() �У������ʵ�Ũ����������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
�У������ʵ�Ũ����������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
C.����ʾA��B�����ʵ��ܽ�����¶ȱ仯�������![]() ʱA��B�ı�����Һ�ֱ�������
ʱA��B�ı�����Һ�ֱ�������![]() ʱ�����ʵ���������
ʱ�����ʵ���������![]()
D.����ʾ�����£���![]() �������
�������![]()
![]() ��ˮ�У���ҺpH���¶��������������仯����
��ˮ�У���ҺpH���¶��������������仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200mLH2SO4��Fe2(SO4)3�Ļ����Һ�ֳ����ȷݣ�������һ���м����������ۣ��� �ַ�Ӧ���ù�����������3.36g������һ���м�������BaCl2��Һ�������ˡ�ϴ�ӡ�����������õ�23.3g��ɫ����������㣺
(1)ԭ��Һ��c(SO42��)��_____��
(2)ԭ��Һ��H2SO4��Fe2(SO4)3�����ʵ���֮��Ϊ_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com