
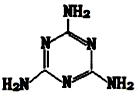
 有机物三聚氰胺的结构如图所示:
有机物三聚氰胺的结构如图所示:分析 (1)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(2)三聚氰胺与水分子间形成氢键;
(3)根据N原子的价层电子对数判断;
(4)根据N原子的杂化类型判断,分子的空间构型;
解答 解:(1)同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>C,氢的第一电离能最小,故答案为:N>C>H;
(2)分子中含有H-N、H-O的化合物能与水分子间形成氢键,三聚氰胺与水分子间形成氢键,所以三聚氰胺分子的水溶性好,故答案为:能溶于水因为三聚氰胺分子与水分子间能形成氢键;
(3)由有机物三聚氰胺结构图可知,分子中N原子形成的化学键为C=N和C-N,形成C=N时,N原子中含有3个价层电子对杂化类型为sp2;形成C-N时,N原子中含有4个价层电子对,杂化类型为sp3,
故答案为:sp2和sp3;
(4)由有机物三聚氰胺结构图可知,六元环上的N原子都是以C=N形式存在,属于sp2杂化,分子的空间构型为平面形,所以分子中所有的N原子在同一平面上;
故答案为:是.
点评 本题考查了物质结构和性质,涉及第一电离能、原子的杂化方式、氢键算等知识点,这些知识点都是高考热点,会根据价层电子对互斥理论确定原子杂化方式及分子空间构型,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、CO32- | B. | H+、Na+、Fe2+、MnO4- | ||
| C. | K+、Ca2+、Cl-、CO32- | D. | K+、NO3-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.55gCl2通入足量水中充分反应,转移电子数为0.05NA | |
| B. | 18gNH4+含有质子数为10NA | |
| C. | 13.8gNO2与足量水反应时,转移电子的数目为0.2NA | |
| D. | 标准状况下,相同体积的SO3、HCl、NO含有的分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O作呼吸面具中的供氧剂 | B. | 小苏打做发酵粉 | ||
| C. | 镁合金用于制造汽车、飞机、火箭 | D. | 漂白粉做消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:
在实验室里,第一位同学取一小块金属钠做与水反应的实验.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 L NH3中所含的原子数为2NA | |
| B. | 2.4g金属镁变为Mg2+时失去的电子数为0.1 NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA个 | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com