
【题目】下列有关物质的量的说法中正确的是()
A. 摩尔是国际七个基本物理量之一 B. 阿伏加德罗常数约为6.02×1023
C. 标况下的气体摩尔体积为22.4L D. lmolH2O的质量为18g
科目:高中化学 来源: 题型:
【题目】根据下表中几种短周期元素的原子半径及主要化合价,回答下列问题:
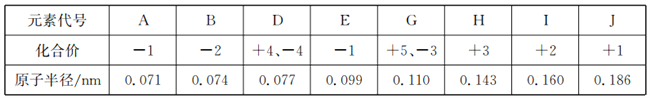
(1)元素D组成的常见单质有两种,分别是_______、________(写名称)。
(2)用电子式表示IE2的形成过程:_________________________。
(3)A、H、J的离子半径由大到小顺序是_________(用离子符号表示)。
(4)78 g J2B2与足量的水反应生成_______L(标准状况下)气体。
(5)元素E的单质与水反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6﹣2 | +5﹣3 | ﹣2 | +3 |
(1)R的元素符号为; M在元素周期表中的位置为 .
(2)X与Y按原子个数比1:1构成的物质的电子式为;所含化学键类型 .
(3)X+ , Y2,M2离子半径由大到小的顺序为(用离子符号表示) .
(4)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的电极反应式 .
Ⅱ如图转化关系A ![]() B
B ![]() C,若B为白色胶状不溶物,则A与C反应的离子方程式为 .
C,若B为白色胶状不溶物,则A与C反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应 2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)的平衡常数为400.此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(molL﹣1) | 0.44 | 0.6 | 0.6 |
下列说法正确的是( )
A.CH3OH的起始浓度为1.04mol/L
B.此时逆反应速率大于正反应速率
C.平衡时CH3OH的浓度为0.04mol/L
D.平衡时CH3OH的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇﹣空气燃料电池(DMFC)是一种高效能、轻污染的车载电池,其工作原理如图.下列有关叙述正确的是( ) 
A.H+从正极区通过交换膜移向负极区
B.负极的电极反应式为:CH3OH(l)+H2O(l)﹣6e﹣=CO2(g)+6H+
C.d导出的是CO2
D.图中b、c分别是O2、甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( ) 
A.黑磷比白磷稳定
B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
实验 | 操作 | 现象 |
I | 常温下将MnO2和12molL﹣1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4molL﹣1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是 .
②II中发生了分解反应,反应的化学方程式是 .
③III中无明显现象的原因,可能是c(H+)或c(Cl﹣)较低,设计实验(图1)IV进行探究: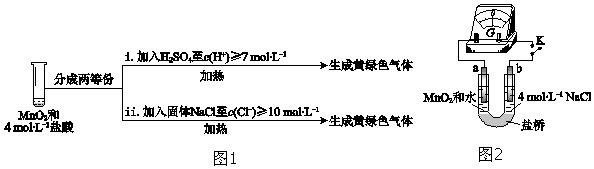
将实验 III、IV作对比,得出的结论是;将 i、ii作对比,得出的结论是 .
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是 .
(2)研究盐酸能否被氧化性酸氧化. ①烧瓶中放入浓H2SO4 , 通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3 , 试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2 .
实验 | 操作 | 现象 |
I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
III | … | … |
通过实验 I、II、III证明混合气体中含有Cl2 , III的操作是 .
由上述实验得出:盐酸能否被氧化与氧化剂的种类、有关.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com