
【题目】下列各组气体,不论以何种比例混合,其密度(同温同压)都不等于N2密度的是( )
A.O2和H2B.C2H4和COC.H2和Cl2D.CH4和C2H2
【答案】D
【解析】
同温同压下,气体摩尔体积相等,根据ρ=![]() 知,气体的密度之比等于其摩尔质量之比,其密度不等于N2的密度,说明该气体的摩尔质量不等于氮气的摩尔质量,氮气的摩尔质量是28g/mol;
知,气体的密度之比等于其摩尔质量之比,其密度不等于N2的密度,说明该气体的摩尔质量不等于氮气的摩尔质量,氮气的摩尔质量是28g/mol;
A.氧气的摩尔质量是32g/mol、氢气的摩尔质量是2g/mol,所以其混合气体的平均摩尔质量可能是28g/mol,故A错误;
B.C2H4和CO的摩尔质量都是28g/mol,所以混合气体的平均摩尔质量一定是28g/mol,故B错误;
C.H2的摩尔质量是2g/mol、Cl2的摩尔质量是71g/mol,所以混合气体的平均摩尔质量可能是28g/mol,故C错误;
D.CH4的摩尔质量是16g/mol、C2H2的摩尔质量是26g/mol,所以混合气体的平均摩尔质量一定不是28g/mol,故D正确;
故答案为:D。


科目:高中化学 来源: 题型:
【题目】焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和H2O。
(1)写出并配平该反应的方程式____;
(2)发生氧化反应的物质是___,反应中4mol的氧化剂能得到___mol电子;
(3)反应中产生了11.2L(标准状况)的气体时,被还原的物质的质量为___g;
(4)向NH4Cl溶液中滴加NaOH溶液并加热会放出气体,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如图,先获得不溶性草酸氧钛钡晶体BaTiO(C2O4)2·4H2O,煅烧后可获得钛酸钡粉体。下列说法不正确的是( )
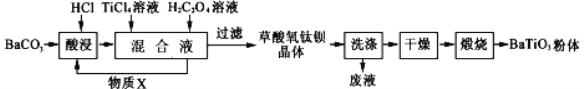
A. 酸浸时发生的反应的离子方程式为:BaCO3+2H+== CO2↑+Ba2++H2O
B. 加入H2C2O4溶液时,发生反应的化学方程式为:BaCl2+2H2C2O4+TiCl4+5H2O=BaTiO(C2O4)2·4H2O↓+6HCl
C. 可循环使用的物质X是CO2
D. 煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、CO2和H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 1mol·L-1的Ca(ClO)2溶液中含Ca2+数目为NA
B. 22.4L Cl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA
C. 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D. 1mol -OH与1mol OH-所含电子数均为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离提纯是化学实验中的重要部分,方法有过滤、蒸发、萃取、蒸馏等,应用广泛,环己醇脱水是合成环己烯的常用方法,实验室合成环己烯的反应和实验装置如图:
![]()

可能用到的有关数据如下:

Ⅰ.合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
Ⅱ.分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是__。
(2)加入碎瓷片的作用是__;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是__(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并__;在本实验分离过程中,产物应该从分液漏斗的__(填“上口倒出”或“下口倒出”)。
(4)分离提纯过程中加入无水氯化钙的目的是__。
(5)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__(填正确答案标号)。
A.蒸馏烧瓶 B.温度计 C.分液漏斗 D.牛角管 E.锥形瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了能观察到丁达尔效应,成外高新科学社的同学在实验室制备Fe(OH)3胶体。
(1)胶体与其它分散系的本质区别是:______________________________________。
(2)制备时,将_________逐滴滴加至_________中,待液体呈_________后,停止加热;反应方程式为_______________________________________。
(3)如何设计实验验证制得的氢氧化铁是胶体?_______________________________。
(4)周珊同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3胶体中逐滴加入了稀H2SO4,结果出现了一系列变化。①先出现红褐色沉淀,原因是_______________________________②随后沉淀溶解,此反应的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3mol NH3中含有质子数与_________g H2O分子中所含质子数相等。
(2)100mL Al2(SO4)3溶液中c(SO42-)=0.9 mol/L,则n[Al2(SO4)3]=_____________。
(3)10mL 6 mol/L稀硫酸加水稀释到200mL,稀释后c(H+)=__________。
(4)已知某饱和NaCl溶液的体积为VmL。密度为ρg/cm3,质量分数为w。物质的量浓度为C mol/L,溶液中含NaCl的质量为m g.
①用m、V表示溶液物质的量浓度__________;
②用w、ρ表示溶液物质的量浓度__________;
③用w表示该温度下NaCl的溶解度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脂环烃分子中两个或两个以上碳环共有两个以上碳原子的烃称为桥环烃,二环[4.1.0]庚烷(![]() )是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是( )
)是一种典型的桥环烃,下列关于二环[4.1.0]庚烷的说法错误的是( )
A. 与环庚烯互为同分异构体
B. 所有的碳原子均在同一平面上
C. 一氯代物有4种(不考虑立体异构)
D. 1mol二环[4.1.0]庚烷完全燃烧时消耗10molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如下(部分反应条件略去):

已知:
①有机物A的质谱与核磁共振氢谱图如下:

②
③
回答下列问题:
(1)A的名称是__________________;C中含氧官能团的名称是________________。
(2)反应②的反应类型是____________________。
(3)反应①的化学方程式是__________________________。
(4) F的结构筒式是_____________________。
(5)同时满足下列条件的G的同分异构体共有___________种(不含立体结构);写出其中一种的结构简
式:________________。
①能发生银镜反应 ②能发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1 mol该物质最多能与8 mol NaOH反应
(6) 参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备 的合成路线:_______________________。
的合成路线:_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com