
【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解。PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请答下面问题:
(1)选下图所示发生装置,可分别制备氯气

你选用的装置是___________,反应的离子方程式为____________
(2)实验室常用下图所示装置制取PCl3。

①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______,然后稍稍用力即可把玻璃管插入橡皮管。
②B中所盛试剂是____________________,F中碱石灰的作用是_____________________。
③实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是______________________________,C装置中的K1、 K2的设计也出于类似的目的,为了达到这—实验目的,实验时与K1、 K2有关的操作是___________________。
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5,加入红磷时发生反应的化学方程式为_________________________,然后通过__________________(填实验操作名称),即可得到较纯净的PCl3。
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI, I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_______ 。
【答案】 ②或③; 2MnO4-+10Cl-+16H+= 2Mn2++5Cl2↑+8H2O或MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。 玻璃管口用水润湿 浓硫酸 吸收多余的Cl2 ,防止空气中的水蒸气进入烧瓶与PCl3反应 排尽装置中的空气,防止PCl3 与O2反应 先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2 3PCl5+2P=5PCl3 蒸馏 82.5%
Mn2++Cl2↑+2H2O。 玻璃管口用水润湿 浓硫酸 吸收多余的Cl2 ,防止空气中的水蒸气进入烧瓶与PCl3反应 排尽装置中的空气,防止PCl3 与O2反应 先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2 3PCl5+2P=5PCl3 蒸馏 82.5%
【解析】实验室要用红磷与干燥的氯气模拟工业生产制取PCl3 流程为:利用②或③装置制得氯气,因PCl3遇水会强烈水解,所以氯气需干燥,B装置利用浓硫酸干燥氯气,利用二氧化碳排尽装置中的空气,PCl3沸点为75.5℃,利用E装置防止PCl3挥发(冷凝),因尾气中含有有毒气体氯气,且空气中水蒸气可能进入装置,所以用F装置利用碱石灰吸收多余的氯气,防止空气中的水蒸气进入烧瓶和PCl3反应。
(1)实验前玻璃管之间连接需要用到橡皮管,其连接方法是先用水润湿玻璃管口。
(2)氯气为酸性气体,需用酸性干燥剂干燥,吸收多余的氯气,防止空气中的水蒸气进入烧瓶与PCl3反应。
(3)因为PCl3遇氧气会生成POCl3,遇水生成H3PO3和HCl,红磷在温度较高的条件下能自燃,通入二氧化碳赶净空气,通入二氧化碳赶净空气,避免水和氧气与三氯化磷发生反应;先关闭 K1,打开K2,利用氯气排净装置中的空气。
(4)根据物质的沸点数值不同,可以利用蒸馏的方法分离出三氯化磷。
(5)通过滴定原理测定混合物中PCl3的质量分数,可借助于原子守恒并结合关系式为PCl3—H3PO3—I2和2Na2S2O3--I2,进行计算。
(1)如果选用②装置,可以用酸性高锰酸钾溶液与浓盐酸反应生成氯化钾、氯化锰、氯气和水,反应的离子方程式为2MnO4-+10Cl-+16H+= 2Mn2++5Cl2↑+8H2O;如果选用③装置,可以用二氧化锰与浓盐酸加热反应制备氯气,生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;正确答案:②或③;2MnO4-+10Cl-+16H+= 2Mn2++5Cl2↑+8H2O或MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;正确答案:②或③;2MnO4-+10Cl-+16H+= 2Mn2++5Cl2↑+8H2O或MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把玻璃管口用水润湿,然后稍稍用力即可把玻璃管插入橡皮管;正确答案:先把玻璃管口用水润湿。
②PCl3遇水会强烈水解,因此氯气必须干燥,B中所盛试剂是浓硫酸,吸收水蒸气;由于氯气有毒,污染环境,F中碱石灰的作用是吸收多余的Cl2 ,同时防止空气中的水蒸气进入烧瓶与PCl3反应;正确答案:浓硫酸;吸收多余的Cl2 ,防止空气中的水蒸气进入烧瓶与PCl3反应。
③根据题给信息可知,因为PCl3 遇O2会生成POCl3,遇水生成H3PO3和HCl,所以通干燥CO2的作用是排尽装置中的空气,防止PCl3 与O2反应;C装置中的K1、 K2的设计也出于类似的目的,具体操作为:先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2;正确答案:排尽装置中的空气,防止PCl3 与O2反应;先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2。
(3)PCl5与红磷发生加成反应生成PCl3,反应的化学方程式为3PCl5+2P=5PCl3;利用PCl3与POCl3均为液体,沸点不同,采用蒸馏的方法进行分离提纯;正确答案:3PCl5+2P=5PCl3;蒸馏。
(4)根据题给信息可知:滴定实验涉及关系式为PCl3—H3PO3—I2和2Na2S2O3--I2,设混合物中PCl3的物质的量为nmol,水解生成的H3PO3反应掉的I2的物质的量为nmol;滴定多余I2的消耗的Na2S2O3的物质的量为0.1×8.40×10-3=8.4×10-4mol,多余的I2的物质的量为0.0008/2=0.0004mol,提供I2的总物质的量0.1×10×10-3mol,H3PO3反应掉的I2的物质的量: 1×10-3-0.0004=0.0006 mol,25.00mL溶液里含有PCl3的质量为0.0006×137.5=0.0825g,则250mL溶液中,含有PCl3的质量为0.825 g,产品中PCl3的质量分数为0.825/1×100%=82.5%;正确答案:82.5%。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下列7种有机物:
①CH4 ②![]() ③
③ ④
④ ⑤
⑤ ⑥
⑥![]() ⑦
⑦
请回答:其中属于醇类的是________(填序号,下同),互为同系物的是_______,能与金属钠反应的有_________,互为同分异构体的是________。
(2)肉桂酸甲酯由C、H、O三种元素组成,已知其相对分子质量为162,核磁共振氢谱显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图,则肉桂酸甲酯的结构简式是 ____________________(不考虑立体异构)。

(3)写出2-甲基-2-丁烯的结构简式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
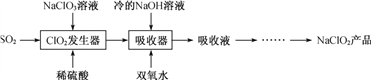
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水的电离程度小于A2溶液中水的电离程度;相同浓度时,B1溶液中水的电离程度小于B2溶液中水的电离程度。(说明: ![]() 不稳定,不考虑)
不稳定,不考虑)
请填写下列空白:
(1)写出化学式:A1___________、A2__________、B1___________、B2___________。
(2)已知, ![]() ,则
,则![]() 和
和![]() 等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
等体积混合组成溶液中离子浓度由大到小的顺序为______________________。
(3)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是_________________。
(4)常温下,若B1、B2两种溶液的pH=5,则两溶液中由水电离出的氢离子的物质的量浓度之比为________。
(5)常温下, ![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() 的电离平衡常数Ka_______________。
的电离平衡常数Ka_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来。
B. 聚合物![]() 可由单体CH3CH=CH2和CH2=CH2加聚制得。
可由单体CH3CH=CH2和CH2=CH2加聚制得。
C. 相对分子质量为72的某烷烃,一氯代物有4种。
D. 植物油氢化、塑料和橡胶的老化过程中均发生了加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的氧化物是形成酸雨的罪魁祸首,含硫烟气(主要成分为SO2)的处理备受关注,主要有以下两种方法。请回答下列问题:
Ⅰ.碱液吸收法
步骤1:用足量氨水吸收SO2。
步骤2:再加入熟石灰,发生反应2NH+Ca2++2OH-+SO![]() ===CaSO3↓+2NH3·H2O。
===CaSO3↓+2NH3·H2O。
(1)已知:25 ℃时,Kb(NH3·H2O)=a;Ksp(CaSO3)=b。该温度下,步骤2中反应的平衡常数K=__________(用含a、b的代数式表示)。
Ⅱ.水煤气还原法
已知:ⅰ.2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
ⅱ.2H2(g)+SO2(g) ![]() S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
(2)写出CO(g)与H2O(g)反应生成CO2(g) 、H2(g)的热化学方程式为_______________。
若该反应在绝热、恒容体系中进行,达到平衡的标志___________。
A.氢氧键的断裂速率等于氢氢键的断裂速率
B.混合气体的平均摩尔质量保持不变
C.混合气体的总压强保持不变
D. H2O(g) 与H2(g)的体积比保持不变
(3)反应ⅱ的正反应的活化能E________(填“>”“<”或“=”)ΔH2。
(4)在一定压强下,发生反应ⅱ。平衡时,α(SO2) (二氧化硫的转化率)与原料气投料比[![]() ]和温度(T)的关系如图所示。
]和温度(T)的关系如图所示。

①α(H2):M________(填“>”“<”或“=”)N。
②逆反应速率:M________(填“>”“<”或“=”)Q。
(5)T ℃,向10 L恒容密闭容器中充入2 mol CO(g)、2 mol SO2(g)和2 mol H2(g),发生反应ⅰ和反应ⅱ。5 min达到平衡时,CO2(g)和H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应ⅱ的平衡常数K=________。
②其他条件不变,6 min时缩小容器容积。α(SO2)__________(填“增大”“减小”或“不变”),原因为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是

A. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
B. a点由水电离出的c(H+)=1.0![]() mol/L
mol/L
C. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
D. c点:c(Cl-)=c(NH![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。
(2)硒、砷、溴三种元素的第一电离能从大到小的顺序为___________(用元素符号表示)。
(3)两种三角锥形气态氢化物PH3和NH3的键角分别为93.6°和107°,试分析PH3的键角小于NH3的原因_____________________________________________________________。
(4)常温下PCl5是白色晶体,在148℃时熔化成能导电的熔体。该熔体由A、B两种微粒构成,A、B分别与CCl4、SF6互为等电子体,则A的化学式为__________________,其中心原子杂化方式为_______________。
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为ρg·cm-3),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。


①与Au距离最近的Cu个数为________。
②该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为__________,则晶胞中Cu原子与Au原子中心的最短距离d=________cm。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为__________(![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或实验操作不正确的是
A. 配制10%的ZnSO4溶液,将l0gZnSO4溶解于90g水中
B. 用四氯化碳萃取碘水中的碘时,将碘的四氯化碳溶液从分液漏斗下口放出
C. NaCl溶液蒸发结晶时,蒸发血中有晶体析出并剩余少量液体时即停止加热
D. 检验蔗糖水解产物具有还原性时,先向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com