
【题目】(1)现有下列7种有机物:
①CH4 ②![]() ③
③ ④
④ ⑤
⑤ ⑥
⑥![]() ⑦
⑦
请回答:其中属于醇类的是________(填序号,下同),互为同系物的是_______,能与金属钠反应的有_________,互为同分异构体的是________。
(2)肉桂酸甲酯由C、H、O三种元素组成,已知其相对分子质量为162,核磁共振氢谱显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图,则肉桂酸甲酯的结构简式是 ____________________(不考虑立体异构)。

(3)写出2-甲基-2-丁烯的结构简式:____________________________________
【答案】 ⑦ ①④ ⑥⑦ ③⑤ ![]() (CH3)2C=CHCH3
(CH3)2C=CHCH3
【解析】
(1)因醇是羟基和链烃基相连,根据结构简式,其中属于醇类的是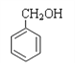 填序号,⑦;同系物是结构相似,分子组成相差一个或几个(CH2)n原子团。互为同系物的是:①④,能与金属钠反应的官能团有羟基,羧基,所以有⑥⑦;同分异构体是分子式相同,结构不同。互为同分异构体的是③⑤。
填序号,⑦;同系物是结构相似,分子组成相差一个或几个(CH2)n原子团。互为同系物的是:①④,能与金属钠反应的官能团有羟基,羧基,所以有⑥⑦;同分异构体是分子式相同,结构不同。互为同分异构体的是③⑤。
(2)由红外光谱可以知道肉桂酸甲酯分子中含有双键和酯基,苯环,则其相对分子质量是162,确定分子式为![]() ,核磁共振氢谱图中有六个吸收峰,峰面积比为
,核磁共振氢谱图中有六个吸收峰,峰面积比为![]() ,说明有6种氢,其结构简式为:
,说明有6种氢,其结构简式为: ![]() ,
,
因此,本题正确答案是: ![]() 。
。
(3)写出2-甲基-2-丁烯的结构简式:(CH3)2C=CHCH3


科目:高中化学 来源: 题型:
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
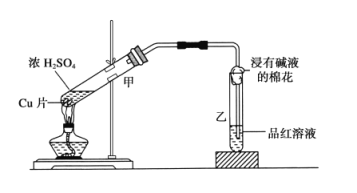
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、NH、I—、CO![]()
B. 0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl—、SO![]()
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO![]() 、AlO
、AlO
D. 水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是

A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH)
D. 点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是( )
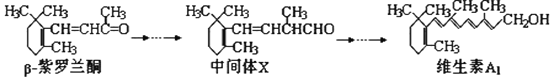
A. β—紫罗兰酮与中间体X互为同分异构体
B. β—紫罗兰酮不可使酸性KMnO4溶液褪色
C. 维生素A1易溶于NaOH溶液
D. 1mol维生素A1最多能与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀镀在绝缘板上的铜箔,制造印刷电路板。
(1)写出FeCl3溶液与金属铜发生反应的离子方程式:_________________________。
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备用如图所示步骤:
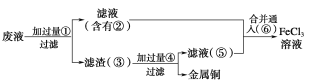
A.写出上述实验中加入或生成的有关物质的化学式:
①________;②________;③________;④________;⑤________;⑥________。
B.写出下列过程中的离子方程式:
①→②___________________________________;
⑤+⑥_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol·L1的硫酸,其他试剂任选.填写下列空白.
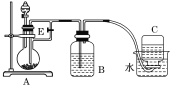
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是________________________________________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,装置B中发生的现象为 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化磷(PCl3)是一种用于有机合成的重要催化剂。已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解。PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请答下面问题:
(1)选下图所示发生装置,可分别制备氯气

你选用的装置是___________,反应的离子方程式为____________
(2)实验室常用下图所示装置制取PCl3。

①玻璃管之间的连接需要用到胶皮管,连接的方法是:先把_______,然后稍稍用力即可把玻璃管插入橡皮管。
②B中所盛试剂是____________________,F中碱石灰的作用是_____________________。
③实验时,检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是______________________________,C装置中的K1、 K2的设计也出于类似的目的,为了达到这—实验目的,实验时与K1、 K2有关的操作是___________________。
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5,加入红磷时发生反应的化学方程式为_________________________,然后通过__________________(填实验操作名称),即可得到较纯净的PCl3。
(4) 通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液:
②取以上溶液25.00mL,向其中加入10.00mL0.1000mol/L碘水(足量),充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol/L的Na2S2O3溶液滴定;
④重复②、③操作,平均消耗0.1000 mol/L Na2S2O3溶液8.00mL.
己知:H3PO3+I2+H2O=H3PO4+2HI, I2+2Na2S2O3=2NaI+Na2S4O6,根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为_______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com