
【题目】如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol·L1的硫酸,其他试剂任选.填写下列空白.
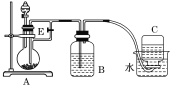
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是________________________________________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,装置B中发生的现象为 ______________________。
【答案】铁屑 Fe+2H+===Fe2++H2↑ 打开 H2 关闭活塞E,使FeSO4溶液压入B瓶中进行反应 白色沉淀迅速变成灰绿色,最终变成红褐色
【解析】
制取氢氧化亚铁使用的试剂是硫酸亚铁和氢氧化钠溶液,但是一定要注意隔绝氧气的氧化,所以B装置中是氢氧化钠,A是产生硫酸亚铁的装置,保证其进入B中,要借助氢气产生的压强,根据实验试剂以及原理来回答分析即可。
(1)制取氢氧化亚铁使用的试剂是硫酸亚铁和氢氧化钠溶液,但是一定要注意隔绝氧气的氧化,所以B装置中是氢氧化钠,A是产生硫酸亚铁的装置,因此A中应预先加入的试剂是铁,再滴入酸即可,发生反应为Fe+2H+=Fe2++H2↑;
(2)为保证酸顺利滴下,一定在实验开始时就先将活塞E打开,A中反应为Fe+2H+===Fe2++H2↑,最后产生的氢气被C装置收集;
(3)A中反应发生后,为保证硫酸亚铁进入B中和氢氧化钠混合,要借助氢气产生的压强,所以需要关闭活塞E,使硫酸亚铁溶液压入B瓶中进行反应;
(4)氢氧化亚铁可以被氧气氧化为氢氧化铁,因此拔去装置B中的橡皮塞,使空气进入,装置B中发生的现象为白色沉淀迅速变成灰绿色,最终变成红褐色。


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ·mol-1
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
合成氨反应的热化学方程式为_____________________________。
(2)恒温恒容条件下,起始按物质的量之比为1∶1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_______________;然后只降低温度,N2(g)的体积分数会_________(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃时,CO2(g)和NH3(g)合成尿素的原理为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
①0~2min内,用NH3表示的反应速率υ(NH3)=___________;反应的平衡常数K=____________。
②若其他条件不变,2 min时将容器体积迅速压缩到1L,在3 min时重新达到平衡,请在图1中画出2~3 min内c(NH3)随时间(t)变化的曲线关系图。

(4)碱性氨气燃料电池的装置如图2 所示,写出负极的电极反应式____________________。当电路中每通过3.6 mol e-,则需要标况下空气的体积________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]()
![]()
![]() ③
③
![]()
![]()
![]() ④
④
请回答下列问题
(1)若反应②生成标准状况下的33.6LN2O,则转移电子数为______ 。
(2)反应③中物质X的化学式是 _______________。
(3)反应④中氧化产物是 ___________。(填化学式)
II.某同学写出以下三个化学方程式(未配平):
①NO+HNO2→N2O3+H2O ②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2 其中你认为有可能实现的是_________________。
III.下列三个氧化还原反应中,氧化剂氧化性由强到弱的顺序是_________________。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列7种有机物:
①CH4 ②![]() ③
③ ④
④ ⑤
⑤ ⑥
⑥![]() ⑦
⑦
请回答:其中属于醇类的是________(填序号,下同),互为同系物的是_______,能与金属钠反应的有_________,互为同分异构体的是________。
(2)肉桂酸甲酯由C、H、O三种元素组成,已知其相对分子质量为162,核磁共振氢谱显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图,则肉桂酸甲酯的结构简式是 ____________________(不考虑立体异构)。

(3)写出2-甲基-2-丁烯的结构简式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下:

(1) “还原”步骤中BaS不宜过量太多的原因是______。
(2)滤渣的成分是______。
(3)结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是______。
(4)利用如图装置将MgBr2·6H2O脱水得到MgBr2。

①通入HBr的目的是______。
②图中框内装置的作用是______。
(5)已知:BaS+H2O2=Ba(OH)2+S↓。请补充完整实验室由BaS制取高纯BaSO3的实验方案:取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2,过滤,______,(实验中须使用的试剂有:SO2气体,溶有SO2的水,除常用仪器外须使用的仪器有:真空干燥箱、pH计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O =4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为______。
(2)NO中氮原子轨道的杂化类型是______。
(3)与HNO2互为等电子体的一种阴离子的化学式为______。
(4)配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是______。
(5)CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有______。
(6)镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
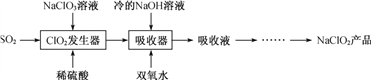
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是

A. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
B. a点由水电离出的c(H+)=1.0![]() mol/L
mol/L
C. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
D. c点:c(Cl-)=c(NH![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com