
【题目】I.已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]()
![]()
![]() ③
③
![]()
![]()
![]() ④
④
请回答下列问题
(1)若反应②生成标准状况下的33.6LN2O,则转移电子数为______ 。
(2)反应③中物质X的化学式是 _______________。
(3)反应④中氧化产物是 ___________。(填化学式)
II.某同学写出以下三个化学方程式(未配平):
①NO+HNO2→N2O3+H2O ②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2 其中你认为有可能实现的是_________________。
III.下列三个氧化还原反应中,氧化剂氧化性由强到弱的顺序是_________________。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
【答案】6NA H2O N2 ③ KMnO4>Cl2>FeCl3>I2
【解析】
I.(1)根据化合价的变化计算转移的电子;
(2)利用原子守恒判断X的化学式;
(3)得电子被还原,得到还原产物,失电子被氧化,得到氧化产物;
II.依据氧化还原反应化合价变化规律,如果发生氧化还原反应,则一定有元素化合价升降,据此分析解答;
III.根据氧化剂的氧化性强于氧化产物的氧化性分析解答。
I.(1)若反应②生成标准状况下的33.6LN2O,物质的量是33.6L÷22.4L/mol=1.5mol,铵根中氮元素从-3价升高到+1价,硝酸根中氮元素从+5价降低到+1价,转移4个电子,则转移电子的物质的量是6mol,电子数为6NA。
(2)根据原子守恒可知反应③中物质X的化学式是H2O。
(3)铵根中氮元素从-3价升高到0价,失去电子被氧化,硝酸根中氮元素从+5价降低到+4价,得到电子被还原,则反应④中氧化产物是N2。
II.①NO+HNO2→N2O3+H2O:NO中氮元素化合价从+2价升高到+3价,而亚硝酸中氮元素化合价不变,不符合氧化还原反应规律,不能发生;
②NH3+NO→HNO2+H2O:氨气中氮元素从-3价升高到+3价,NO中氮元素化合价从+2价升高到+3价,没有化合价降低,不符合氧化还原反应规律,不能发生;
③N2O4+H2O→HNO3+HNO2:四氧化二氮中氮元素从+4价部分降低到+2价,部分升高到+5价,符合氧化还原反应规律,可以发生,答案选③。
III.①2FeCl3+2KI=2FeCl2+2KCl+I2中氧化剂是氯化铁,氧化产物是碘,则氧化性FeCl3>I2;
②2FeCl2+Cl2=2FeCl3中氧化剂是氯气,氧化产物是氯化铁,则氧化性Cl2>FeCl3;
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中氧化剂是高锰酸钾,氧化产物是氯气,则氧化性KMnO4>Cl2;
综上所述氧化剂氧化性由强到弱的顺序是KMnO4>Cl2>FeCl3>I2。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】两种一元碱MOH和ROH的溶液分别加水稀释,溶液pH的变化如图所示,下列叙述正确的是

A. MOH是一种弱碱
B. 在x点,((M+)=c(R+)
C. 稀释前,c(MOH)=l0c(ROH)
D. 稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60具有完美的球形结构。之后Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si 的核外电子排布式为____________,C和N元素中第一电离能较大的是________________。
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如图所示,C60属于________晶体;C60中C原子的杂化类型为__________________。

(3)N60的晶体中存在的作用力有____________(填字母)。
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键 F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是______________________________________________。
(5)金属M(相对原子质量为m)与N60形成的化合物晶体结构如图所示(其中白球代表N60,黑球代表金属M),其晶胞边长为k pm,NA代表阿伏加德罗常数的值,则其密度为_______g·cm-3,该化合物中N60的配位数为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、NH、I—、CO![]()
B. 0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl—、SO![]()
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO![]() 、AlO
、AlO
D. 水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO、HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32 g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是( )
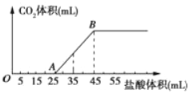
A. OA段发生反应的离子方程式为:H++OH-=H2O、CO32-+H+=HCO3-
B. A点溶液中的溶质为NaCl、NaHCO3
C. 当加入45 mL盐酸时,产生CO2的体积为336mL
D. 混合物中NaOH的质量0.20 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是

A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN—)+ c(HCN)=2c(Cl—)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH)
D. 点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β—紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。下列说法正确的是( )
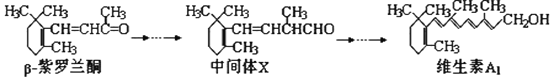
A. β—紫罗兰酮与中间体X互为同分异构体
B. β—紫罗兰酮不可使酸性KMnO4溶液褪色
C. 维生素A1易溶于NaOH溶液
D. 1mol维生素A1最多能与5molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol·L1的硫酸,其他试剂任选.填写下列空白.
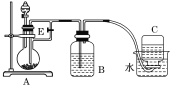
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是________,A中反应的离子方程式是________________________________________。
(2)实验开始时就先将活塞E________(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________________________________。
(4)拔去装置B中的橡皮塞,使空气进入,装置B中发生的现象为 ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)化合物F(![]() )是重要的化工原料,其一种合成路线如下:
)是重要的化工原料,其一种合成路线如下:

已知

(1)写出B的官能团名称___________。
(2)下列有关物质C的说法正确的是________。
A.C的分子式是C9H12O3 B.C的核磁共振氢谱共有4组吸收峰
C.1mlC最多消耗1mol金属Na D.C可以发生取代、加成和消去反应
(3)写出①的化学方程式:____________________________________。
(4)E的结构简式为________________________________________________。
(5) 有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
有多种同分异构体,能发生银镜反应的芳香族化合物有____________种,其中满足下列条件的同分异构体的结构简式为____________
①1mol该物质最多消耗3 mol NaOH; ②苯环上一氯代物只有两种。
(6)参照上述合成路线,设计由乙烯合成2-丁醇的合成路线。(用合成路线流程图表示,并注明反应条件,合过程中只有无机试剂可任选) ____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com