
【题目】C60具有完美的球形结构。之后Si60、N60等球形分子被不断制备出来。回答下列问题:
(1)Si 的核外电子排布式为____________,C和N元素中第一电离能较大的是________________。
(2)富勒烯衍生物具有良好的光电性能,富勒烯(C60)的结构如图所示,C60属于________晶体;C60中C原子的杂化类型为__________________。

(3)N60的晶体中存在的作用力有____________(填字母)。
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键 F.金属键
(4)立方氮化硼(BN)可做磨料,其结构与金刚石相似,二者具有相似性结构的原因是______________________________________________。
(5)金属M(相对原子质量为m)与N60形成的化合物晶体结构如图所示(其中白球代表N60,黑球代表金属M),其晶胞边长为k pm,NA代表阿伏加德罗常数的值,则其密度为_______g·cm-3,该化合物中N60的配位数为__________________。

【答案】 1s22s32p63s23p2 或[Ar]3s23p2 N 分子 sp2 AD 硼原子核外有3个价电子,氮原子核外有5个价电子。在立方氮化硼晶体中,每个硼原子除了利用3个价电子形成的共价键外,还可以提供空轨道,接受氮原子的孤对电子,形成一个配位键,于是在立方氮化硼晶体中硼原子和氮原子都采取sp3杂化方式,这和金刚石中C原子的轨道杂化方式一样,就形成了与金刚石类似的正四面体空间网状结构 ![]() 或
或![]() 4
4
【解析】(1)Si原子核外有14个电子,根据构造原理写出Si的核外电子排布式。用同周期元素第一电离能的变化规律比较C和N的第一电离能。
(2)C60属于分子晶体。C60中每个碳原子形成3个碳碳σ键和1个π键,C原子的杂化类型为sp2杂化。
(3)N60由分子构成,N60分子间存在范德华力,N60分子内N原子间存在共价键。
(4)立方氮化硼结构与金刚石相似的原因是:硼原子核外有3个价电子,氮原子核外有5个价电子。在立方氮化硼晶体中,每个硼原子除了利用3个价电子形成的共价键外,还可以提供空轨道,接受氮原子的孤对电子,形成一个配位键,于是在立方氮化硼晶体中硼原子和氮原子都采取sp3杂化方式,这和金刚石中C原子的轨道杂化方式一样,就形成了与金刚石类似的正四面体空间网状结构。
(5)用“均摊法”确定晶胞中粒子的个数,从而确定晶体的化学式,由晶胞边长计算晶胞体积,1mol晶体的质量除以1mol晶体的体积计算晶体的密度。根据晶胞观察M的配位数,由个数比确定N60的配位数。
(1)Si原子核外有14个电子,根据构造原理,Si的核外电子排布式为1s22s22p63s23p2。同周期从左到右元素的第一电离能呈增大趋势,C和N都是第二周期元素,第一电离能:C![]() N,第一电离能较大的是N。
N,第一电离能较大的是N。
(2)C60属于分子晶体。C60中每个碳原子形成3个碳碳σ键和1个π键,C原子的杂化类型为sp2杂化。
(3)N60由分子构成,N60分子间存在范德华力,N60分子内N原子间存在共价键;答案选AD。
(4)立方氮化硼结构与金刚石相似的原因是:硼原子核外有3个价电子,氮原子核外有5个价电子。在立方氮化硼晶体中,每个硼原子除了利用3个价电子形成的共价键外,还可以提供空轨道,接受氮原子的孤对电子,形成一个配位键,于是在立方氮化硼晶体中硼原子和氮原子都采取sp3杂化方式,这和金刚石中C原子的轨道杂化方式一样,就形成了与金刚石类似的正四面体空间网状结构。
(5)用“均摊法”,1个晶胞中含M:4个,含N60:8![]() +6
+6![]() =4个,M与N60的个数比为1:1,晶体的化学式为MN60;晶胞边长为kpm,晶胞的体积为(k
=4个,M与N60的个数比为1:1,晶体的化学式为MN60;晶胞边长为kpm,晶胞的体积为(k![]() 10-10cm)3,1mol晶体的体积为(k
10-10cm)3,1mol晶体的体积为(k![]() 10-10cm)3
10-10cm)3![]() 4
4![]() NA;1mol晶体的质量为(m+60
NA;1mol晶体的质量为(m+60![]() 14)g;该化合物的密度为(m+60
14)g;该化合物的密度为(m+60![]() 14)g
14)g![]() [(k
[(k![]() 10-10cm)3
10-10cm)3![]() 4
4![]() g/cm3=
g/cm3=![]() g/cm3。根据晶胞,M的配位数为4,M与N60的个数比为1:1,该化合物中N60的配位数为4。
g/cm3。根据晶胞,M的配位数为4,M与N60的个数比为1:1,该化合物中N60的配位数为4。


科目:高中化学 来源: 题型:
【题目】全钒液流电池装置如图,电解液在电解质储罐和电池间不断循环。下列说法错误的是
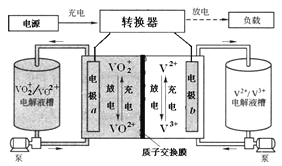
A. 充电时,氢离子通过交换膜移向右侧
B. 充电时,电源负极连接a电极
C. 放电时装置发生的总反应为:VO2++V2++2H+=VO2++V3++H2O
D. 质子交换膜可阻止VO2+与V2+直接发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。

下列说法不正确的是
A. 简单阳离子半径:X< R
B. 最高价含氧酸的酸性:Z < Y
C. M的氢化物常温常压下为气体
D. X与Y可以形成正四面体结构的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ·mol-1
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
合成氨反应的热化学方程式为_____________________________。
(2)恒温恒容条件下,起始按物质的量之比为1∶1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_______________;然后只降低温度,N2(g)的体积分数会_________(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃时,CO2(g)和NH3(g)合成尿素的原理为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
①0~2min内,用NH3表示的反应速率υ(NH3)=___________;反应的平衡常数K=____________。
②若其他条件不变,2 min时将容器体积迅速压缩到1L,在3 min时重新达到平衡,请在图1中画出2~3 min内c(NH3)随时间(t)变化的曲线关系图。

(4)碱性氨气燃料电池的装置如图2 所示,写出负极的电极反应式____________________。当电路中每通过3.6 mol e-,则需要标况下空气的体积________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是__________(填序号)。
A.双氧水 B.75%酒精 C.84消毒液(NaClO溶液) D.苯酚
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为___________________________(答出一条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为_____________________________________。
③图中产物A是一种难溶于水的黑色固体,其化学式为_________________________。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250 mL0.100 0 mol·L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和_________________________、_________________________;
②取KMnO4配成溶液(酸化)后,用0.100 0 mol·L-1标准Na2S2O3溶液进行滴定,判断滴定至终点的现象为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是

A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学——我们的生活,我们的未来”。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:____________。
(2)除去Na2CO3粉末中混入的NaHCO3杂质最佳方法是_________,化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]()
![]()
![]() ③
③
![]()
![]()
![]() ④
④
请回答下列问题
(1)若反应②生成标准状况下的33.6LN2O,则转移电子数为______ 。
(2)反应③中物质X的化学式是 _______________。
(3)反应④中氧化产物是 ___________。(填化学式)
II.某同学写出以下三个化学方程式(未配平):
①NO+HNO2→N2O3+H2O ②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2 其中你认为有可能实现的是_________________。
III.下列三个氧化还原反应中,氧化剂氧化性由强到弱的顺序是_________________。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 标准状况下,11.2L14CO2含有的中子数为11NA
B. 5.6gFe粉与足量S粉加热充分反应转移的电子数为0.2NA,
C. 1molNa2O2固体中所含离子数目为4NA
D. 1LpH=6的纯水中含有OHˉ的数目为10-8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com