
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、NH、I—、CO![]()
B. 0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl—、SO![]()
C. 使甲基橙变红的溶液中:Na+、Mg2+、SO![]() 、AlO
、AlO
D. 水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO、HCO
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
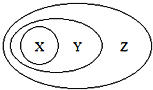
X | Y | Z | |
A | NaAlO2 | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | Al2O3 | 两性氧化物 | 氧化物 |
D | 单质参与反应 | 置换反应 | 氧化还原反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ·mol-1
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
合成氨反应的热化学方程式为_____________________________。
(2)恒温恒容条件下,起始按物质的量之比为1∶1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_______________;然后只降低温度,N2(g)的体积分数会_________(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃时,CO2(g)和NH3(g)合成尿素的原理为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
①0~2min内,用NH3表示的反应速率υ(NH3)=___________;反应的平衡常数K=____________。
②若其他条件不变,2 min时将容器体积迅速压缩到1L,在3 min时重新达到平衡,请在图1中画出2~3 min内c(NH3)随时间(t)变化的曲线关系图。

(4)碱性氨气燃料电池的装置如图2 所示,写出负极的电极反应式____________________。当电路中每通过3.6 mol e-,则需要标况下空气的体积________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果与图像不相符的是

A. 向含有盐酸、氯化镁和氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
B. 向澄清石灰水中通入二氧化碳气体直至过量
C. 向氯化铝的溶液中逐渐加入氢氧化钠溶液直至过量
D. 向氯化铝的溶液中逐渐加入氨水直至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际化学年的中国宣传口号是“化学——我们的生活,我们的未来”。
(1)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:____________。
(2)除去Na2CO3粉末中混入的NaHCO3杂质最佳方法是_________,化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个电化学过程的示意图,回答下列问题:

(1)甲池是___________(填“原电池”、“电解池”或“电镀池”)装置,乙装置中电极A的名称是_______(填“正极”、“负极”、“阴极”或“阳极”)。
(2)甲装置中通入CH4的电极反应式为__________________________________,乙装置中电极B(Ag)的电极反应式为________________________________,丙装置中D极的产物是____________(写化学式)。
(3)一段时间,当丙池中产生112 mL(标准状况)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]()
![]()
![]() ③
③
![]()
![]()
![]() ④
④
请回答下列问题
(1)若反应②生成标准状况下的33.6LN2O,则转移电子数为______ 。
(2)反应③中物质X的化学式是 _______________。
(3)反应④中氧化产物是 ___________。(填化学式)
II.某同学写出以下三个化学方程式(未配平):
①NO+HNO2→N2O3+H2O ②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2 其中你认为有可能实现的是_________________。
III.下列三个氧化还原反应中,氧化剂氧化性由强到弱的顺序是_________________。
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列7种有机物:
①CH4 ②![]() ③
③ ④
④ ⑤
⑤ ⑥
⑥![]() ⑦
⑦
请回答:其中属于醇类的是________(填序号,下同),互为同系物的是_______,能与金属钠反应的有_________,互为同分异构体的是________。
(2)肉桂酸甲酯由C、H、O三种元素组成,已知其相对分子质量为162,核磁共振氢谱显示有6个峰,其面积之比为1︰2︰2︰1︰1︰3 ,利用红外光谱仪检测其中的某些基团,测得红外光谱如下图,则肉桂酸甲酯的结构简式是 ____________________(不考虑立体异构)。

(3)写出2-甲基-2-丁烯的结构简式:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
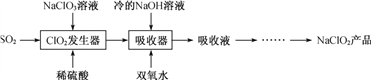
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-![]() 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I-![]() 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-![]() Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2![]() Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com