
| A. | NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等 | |
| B. | NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 | |
| C. | NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度 | |
| D. | NaCl溶液的pH大于NaClO溶液的pH |
分析 根据氯化钠溶液中的电荷守恒可知:c(Na+)+c(H+)=c(Cl-)+c(OH-),NaClO溶液中满足c(Na+)+c(H+)=c(ClO-)+c(OH-),NaCl溶液呈中性,NaClO溶液呈碱性,则NaClO溶液中c(H+)较小,所以NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度,据此进行判断.
解答 解:A.两溶液中总电荷浓度为2c(Na+)+2c(H+),由于次氯酸根离子部分水解,导致溶液显示碱性,则次氯酸钠溶液中c(H+)小于NaCl溶液的c(H+),则氯化钠溶液中离子总浓度大于次氯酸钠,故A错误;
B.由电荷守恒可知,NaCl溶液中c(Na+)+c(H+)=c(Cl-)+c(OH-),NaClO溶液中c(Na+)+c(H+)=c(ClO-)+c(OH-),NaCl溶液呈中性,NaClO溶液呈碱性,则NaClO溶液中c(H+)较小,则NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度,故B正确;
C.根据C的分析可知,NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度,故C错误;
D.NaCl为强酸强碱盐,溶液呈中性,NaClO为强碱弱酸盐,溶液呈碱性,则NaClO溶液的pH较大,故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,侧重于学生的分析能力的考查,为高考常见题型,注意把握盐类水解和弱电解质的电离特点,结合电荷守恒、物料守恒解答该题.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| B. | 10g46%的乙醇水溶液中所含氢原子数目为0.06NA | |
| C. | 1L1 mol•L-1的NH4NO3溶液中含有NH4+数目为NA | |
| D. | 25℃时,100mlpH=13的Ba(OH)2溶液中OH-的数目为0.01NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
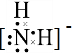 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com