
锌(Zinc)是第四“常见”的金属,仅次于铁、铝及铜,在现代工业中对于电池制造有不可磨灭的贡献。
Ⅰ.湿法炼锌
某种冶炼过程可用下图简略表示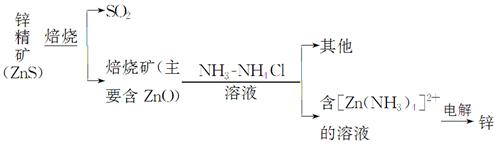
(1)ZnS焙烧反应的化学方程式为_____________________________________。
(2)电解过程中析锌一极的电极反应式为_______________________________。
(3)氧化锌像氧化铝一样,属于两性氧化物,则氧化锌与氢氧化钠反应的离子方程式为_________________________________________________________。
(已知:“锌酸”的化学式可写成H2[Zn(OH)4])
Ⅱ.锌电池
用锌作负极的电池生活中随处可见,如锌锰干电池、锌锰碱性电池、锌空电池等。
(4)锌锰碱性电池,以二氧化锰为正极,锌粒为负极,氢氧化钾溶液为电解液。其具有容量大、放电电流大的特点,因而得到广泛应用。电池总反应式为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2。
碱性电池中,负极锌由片状改变成粒状的优点是_______________________;正极反应式为________________________________________________________________________。
(5)新型锌空电池(如图)与锂电池相比,锌空气充电电池的储存电量是它的三倍,成本是锂电池的一半,并且完全没有过热爆炸的安全隐患。该电池的总反应为2Zn+O2=2ZnO,电解质溶液为KOH溶液,则负极的电极反应式为__________________________。若以该电池为电源,用惰性电极电解硝酸银溶液,为保证阴极有10.8 g银析出,至少需要________L空气(折算成标准状况)进入该电池。
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:填空题
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三元素名称______、______、______。
(2)C在元素周期表中的位置是_____________________________________。
(3)B的原子结构示意图为________,C的氢化物与B的氢化物的稳定性强弱顺序为________>________(填化学式)。
(4)比较A、C的原子半径:A________C,写出A的气态氢
化物与A的最高价氧化物对应水化物反应的化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲元素的原子序数是11,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为__________________________。乙单质与丙单质反应的化学方程式为______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)10Be和9Be________。
a.是同一种原子
b.具有相同的中子数
c.具有相同的化学性质
(2)Al和Be具有相似的化学性质,写出BeCl2水解反应的化学方程式_______________。
(3)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是_________
_______________________________________________________________。
a.比较这两种元素的单质的硬度和熔点
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.将空气中放置已久的这两种元素的单质分别和热水作用
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序________(用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干燥剂,此化合物的电子式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题: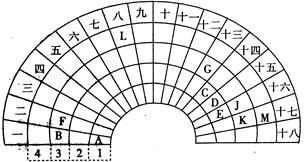
(1)元素C的最高价氧化物的电子式为 ;元素G的离子结构示意图为 。
(2)元素L位于周期表的第 族, 1mol/L LM2溶液500ml与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_______性,原因是___________
_____________________________________________________(用离子方程式表示)
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的则该反应的化学方程式为 。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
图示法和图像法都是常用的科学研究方法。
(1)科学家通过X射线推测胆矾中既含有配位键又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示。
①写出基态Cu原子的核外电子排布式____________________。
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)________。
(2)下图是研究部分元素氢化物的沸点变化规律的图像,折线c可以表达出第________族元素氢化物的沸点变化规律。两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是________(填“a”或“b”),理由是______________________________________________________________。
(3)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫做第一电离能(设为E)。如图所示:
①同周期内,随着原子序数的增大,E值变化的总趋势是________;
②根据图中提供的信息,试推断E氧________E氟(填“>”、“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,试推断E镁________E钙。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为部分短周期元素化合价及相应原子半径的数据:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.110 | 0.117 | 0.074 | 0.075 | 0.071 | 0.099 | 0.077 |
| 最高化合价 | +6 | +5 | +4 | | +5 | | +7 | +4 |
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
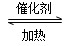 2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
2AD3 ΔH=-47 kJ/mol,在上述平衡体系中加入18D2,当平衡发生移动后,AD2中18D的百分含量________(填“增加”“减少”或“不变”)其原因为______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W的原子序数依次增大。X的氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与主族序数相等;Z的单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。
请回答下列问题:
(1)Y在元素周期表中的位置是________;X的氢化物的电子式是________。
(2)X的氢化物的水溶液与W的氢化物的水溶液混合后恰好反应时,溶液呈________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因:____________________。
(3)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
(4)含Y的两种盐溶液混合产生白色沉淀,写出反应的离子方程式:______________________________________________________。
(5)X、Z、W的最高价氧化物对应的水化物的酸性强弱顺序为________(用化学式表示,下同);Z、W的简单气态氢化物的还原性强弱顺序为________;X、Z、W的最简单氢化物中,沸点最高的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,其中A、C元素的原子最外层电子数相同,且A、C可形成离子化合物,B、F同主族,且C、D、F最高价氧化物的水化物能两两相互反应生成盐和水,F的最外层电子数比C多6,E元素在地壳中的含量仅次于氧,请用化学用语回答下列问题:
(1)写出A、C两种元素组成的化合物的电子式:____________;
(2)B、F的氢化物沸点较高的为____________;
(3)C、D与氧元素形成的常见化合物的水溶液呈碱性,其原因是 (用离子方程式表示)
(4)C、D、B按质量比为23:9:38组成一种化合物,化合物中含有的化学键类型有_______________;
(5)E可与氧元素通过共价键形成原子晶体,其晶胞可看作是在晶体E的晶胞中插入了_______个氧原子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com