
【题目】已知下列热化学方程式:①H2(g)+![]() O2(g)→H2O+285.8kJ ②C(s)+O2(g)→CO2(g)+393.5kJ ③C(s)+H2O(g)→CO(g)+H2(g)-131.5kJ
O2(g)→H2O+285.8kJ ②C(s)+O2(g)→CO2(g)+393.5kJ ③C(s)+H2O(g)→CO(g)+H2(g)-131.5kJ
上述反应中表明反应物的总能量高于生成物的总能量的是___(选填编号)。热化学方程式③所表示的意义是___。
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.一定温度下,在容积为V L的密闭容器中进行反应:aN(g)![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:

(1)此反应的化学方程式中a/b=___________;
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________________;
(3) N的平衡转化率为_______________;
(4)下列叙述中能说明上述反应达到平衡状态的是___________(填字母)。
a.反应中M与N的物质的量之比为1︰1
b.混合气体的总质量不随时间的变化而变化
c.混合气体的总物质的量不随时间的变化而变化
d.单位时间内每消耗a mol N,同时生成b mol M
e.混合气体的压强不随时间的变化而变化
f.N的质量分数在混合气体中保持不变
Ⅱ.研究性学习小组为探究铁与稀盐酸反应,取同质量、体积的铁片、同浓度的盐酸做了下列平行实验:
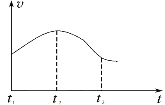
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现放出氢气的速率变化如图所示:
实验②:把铁片投入到含FeCl3的同浓度稀盐酸中,发现放出氢气的量减少。
实验③:在稀盐酸中滴入几滴CuCl2溶液,用铁片做实验,发现生成氢气的速率加快。
试回答下列问题:
(1)分析实验①中t1~t2速率变化的主要原因是_______,t2~t3速率变化的主要原因是______。
(2)实验②放出氢气的量减少的原因是___________________(用离子方程式表示)。
(3)某同学认为实验③反应速率加快的主要原因是形成了原电池,你认为是否正确?请选择下列相应的a或b作答。a.若不正确,请说明原因_____________________________________。b.若正确,则写出实验③中原电池的正极电极反应式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
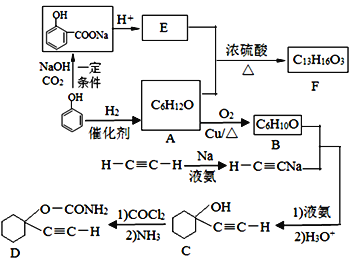
(1)A的化学名称是___,C中含氧官能团的名称为_____。
(2)F的结构简式为____,A和E生成F的反应类型为____。
(3)A生成B的化学方程式为________。
(4)写出由C合成D的第二个反应的化学方程式:________。
(5)同时满足下列条件的E的同分异构体有___种(不含立体异构)。
①遇FeCl3溶液发生显色反应;
②能发生银镜反应
(6)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_____。
(7)
乙炔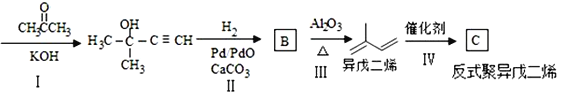
①写出C的结构简式:___
②写出从I至IV的反应类型分别为:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙、丁、戊五种烃,已知它们是C2H6、C2H4、C2H2、C6H6、C6H12(环烷烃)中的一种,实验现象如下:
①甲、乙能使溴水因发生化学反应而褪色;②0.5mol甲能与1molH2反应生成丙,丙不能使溴水和酸性高锰酸钾溶液褪色;③戊可由丁在一定条件下与氢气反应得到。
(1)甲的电子式是___;丙的结构式是____。
(2)写出下列反应的化学方程式:
A.乙与溴水反应______。
B.丁生成戊的反应_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸和醋酸是生产、生活和化学实验中常见的酸。请回答:
(1)人的胃液中含有盐酸,经测定某人胃液的pH为2.0,则其中的c(H+)=___moL。
(2)食醋常用于食品调味,其主要成分为醋酸。醋酸的电离方程式为____。
(3)室温下,pH均为3的盐酸和醋酸溶液,下列各项中相等的是__(填编号)。
①溶液中的c(H+) ②酸的物质的量浓度 ③完全中和时,消耗NaOH的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、 E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
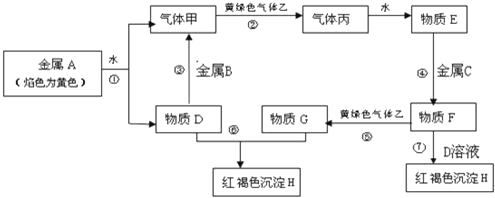
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)说出黄绿色气体乙的一种用途:________________。反应过程⑦可能观察到的实验现象是________________。
(3)反应①的离子方程式为________________。
(4)反应③中的氧化剂是____________(写化学式,下同)反应④中的还原剂是____________。
(5)写出反应⑤的离子方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法中,正确的是( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 2-甲基丁烷也称为异丁烷
C. ![]() 和
和![]() 互为同系物
互为同系物
D. CH3CH2CH2CH3光照下与氯气反应,只生成1种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大。A原子是元素周期表中原子半径最小的原子;B可以与A形成常温下常见的液态物质;C原子的最外层电子数为比最内层电子数少1;D单质在空气中点燃发出耀眼的白光;E是第3周期非金属性最强的元素。
(1)A、B形成的具有强氧化性的18电子的物质的电子式为:___________
(2)C、D最高价氧化物的水化物的碱性__>__。(填化学式)
(3)B、C形成的简单离子半径大小__>__。(填具体离子符号)
(4)E的最高价氧化物的水化物与D的最高价氧化物的水化物在溶液中反应的离子方程式___________
(5)写出化合物CE的形成过程为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com