
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、 E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
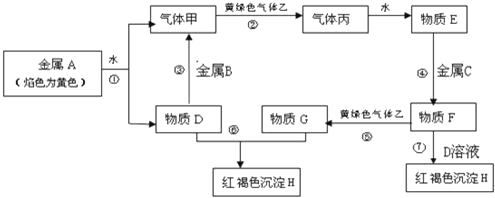
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B__________、丙__________。
(2)说出黄绿色气体乙的一种用途:________________。反应过程⑦可能观察到的实验现象是________________。
(3)反应①的离子方程式为________________。
(4)反应③中的氧化剂是____________(写化学式,下同)反应④中的还原剂是____________。
(5)写出反应⑤的离子方程式:________________。
【答案】Al HCl 自来水消毒或者工业制盐酸、制备漂白粉等 白色沉淀→灰绿色→红褐色沉淀 2Na+2H2O=2Na++2OH+H2↑ H2O Fe 2Fe2++Cl2=2Fe3++2Cl-
【解析】
金属A焰色反应为黄色,故A为Na.Na与水反应生成D为NaOH、气体甲为H2.氢氧化钠与金属B反应生成氢气,故B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,由元素守恒可知,金属C为Fe,故F为FeCl2,G为FeCl3,据此分析。
金属A焰色反应为黄色,故A为Na.Na与水反应生成D为NaOH、气体甲为H2.氢氧化钠与金属B反应生成氢气,故B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应得到F,F与氯气反应得到G,由元素守恒可知,金属C为Fe,故F为FeCl2,G为FeCl3。
(1)由以上分析可知,B为Al,丙为HCl,故答案为:Al;HCl;
(2)黄绿色气体乙为Cl2,可以用于自来水消毒或者工业制盐酸、制备漂白粉等,故答案为:自来水消毒或者工业制盐酸、制备漂白粉等;⑦可能观察到的实验现象为白色沉淀→灰绿色→红褐色沉淀,故答案为:白色沉淀→灰绿色→红褐色沉淀;
(3)反应①的离子方程式为:2Na+2H2O=2Na++2OH+H2↑,故答案为:2Na+2H2O=2Na++2OH+H2↑;
(4)反应③中的氧化剂是H2O,反应④中的还原剂是Fe;
(5)反应⑤的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。


科目:高中化学 来源: 题型:
【题目】能源问题是当今世界的重要课题,研究反应中的能量变化尤为重要。下列变化过程中的能量变化符合图示过程的是( )

A.焦炭制水煤气B.酸碱中和反应
C.铝与氧化铁的高温反应D.浓硫酸的稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B. 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-akJ·mol-1,则中和热为a/2kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l);△H1=-akJ·mol-1,则氢气燃烧热为akJ·mol-1
D. N2(g)+3H2(g)=2NH3(g);△H=-akJ·mol-1,则将14gN2(g)和足量H2置于一密闭容器中,充分反应后放出0.5akJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:①H2(g)+![]() O2(g)→H2O+285.8kJ ②C(s)+O2(g)→CO2(g)+393.5kJ ③C(s)+H2O(g)→CO(g)+H2(g)-131.5kJ
O2(g)→H2O+285.8kJ ②C(s)+O2(g)→CO2(g)+393.5kJ ③C(s)+H2O(g)→CO(g)+H2(g)-131.5kJ
上述反应中表明反应物的总能量高于生成物的总能量的是___(选填编号)。热化学方程式③所表示的意义是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如下图所示。下列有关说法正确的是
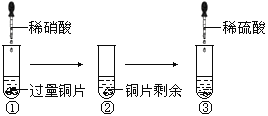
A. 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B. 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C. 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4=4CuSO4+2NO↑+4H2O
D. 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-![]() 2AlO2-+H2↑
2AlO2-+H2↑
C. 室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氢氧化钾;⑦氢氧化铁胶体;⑧氨水;⑨空气;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的___________,属于非电解质的有____________。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H+ + OH- = H2O,该反应的化学方程式为________。
(3)除去③中少量②的操作是___________,化学方程式为__________。
(4)现有10mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是____________。
(5)若在⑦中缓慢加入①的水溶液,产生的现象是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8 ℃,沸点44.8 ℃)的模拟装置如图所示(加热和夹持装置省略):
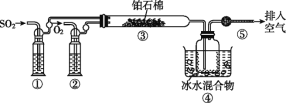
下列说法正确的是( )
A.装置①中的试剂为饱和NaHSO3溶液
B.实验室可用铜与浓硫酸在常温条件下制取SO2
C.装置③反应管中的铂石棉用作反应的催化剂
D.从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态Ni2+的价层电子轨道表达式为________,C、N、O的第一电离能从小到大的顺序为________。
(2)N、P可形成一些复杂离子,如(CH3)3NH+、NO2+、PCl6-等。
①(CH3)3NH+ 中N原子的杂化类型为___,NO2+的空间构型为______________。
②PCl5是一种白色固体,在加压下于148℃时液化,形成一种能导电的熔体。熔体能导电的原因是___________。
(3)Fe、Ni易与CO形成配合物,Fe(CO)5中σ键与π键个数比为______,Ni(CO)4熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,Ni(CO)4为______晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
① 熔点FeO_____NiO(填“>”、“<”或“=”)。
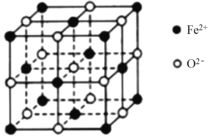
② FeO 晶胞如下图,Fe2+的配位数为_______。
③ FeO在氧气中加热,部分Fe2+被氧化为Fe3+,晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为a cm,密度为g·cm-3,则x=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com