
����Ŀ��[��ѧһѡ��5���л���ѧ����]
���ںϳ�-���ڵ��ڼ���ҩ���м���Ļ�����H����ϳ�·������ͼ��ͼ��
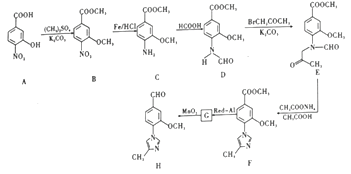
�ش�����������
(1)B�еĺ�������������Ϊ____________��______________ ��___________________��
(2)B��C�ķ�Ӧ����Ϊ_________________��
(3)д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ��___________________��
�ٺ��б������ҷ�������һ������̼ԭ�������ܷ���ˮ�ⷴӦ������һ��ˮ����������ֻ��2�ֲ�ͬ��ѧ�������⣬�ҷ����֮��Ϊ2��1��
(4)G�ķ���ʽΪC12H14N2O2���������õ�H��д��G�Ľṹ��ʽ��_____________��
(5)���ݺϳ�·���е���Ϣ����д����![]() ��
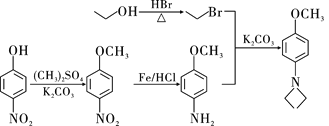
��![]() ��(CH3)2SO4Ϊԭ���Ʊ�
��(CH3)2SO4Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ_________________________________(���Լ����ã��ϳ�·������ͼʾ�����������)��
�ĺϳ�·������ͼ_________________________________(���Լ����ã��ϳ�·������ͼʾ�����������)��
���𰸡� �Ѽ� ���� ���� ��ԭ��Ӧ 
����������1��B�к��������ŵ�����Ϊ�������������Ѽ���
��2��B��C�ķ�Ӧ����Ϊ��ԭ��Ӧ���������ȥ���л�ԭ����
��3��B��ͬ���칹�壬������Ŀ������Ӧ���б�������������Ҫ��ˮ�����֮һֻ�����ֻ�ѧ������ͬ��H��Ϊ2:1���õ��ò���ֻ���ǶԱ����ӡ��������ˮ�����Ϊ�ᣬӦ����3��C��4��O��һ������̼�����������Ͷȡ���������O����һ��̼����Ȼ�������ͱ�������������Ҫ��֤������̼������Ϊ�����������ᡣ�������Ĵ�Ϊ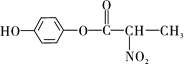 ��д���ɡ�
��д���ɡ�
��4��G�ķ���ʽΪC12H14N2O2���������õ�H��H�ķ���ʽΪC12H12N2O2������G��H�ķ�Ӧ����������ԭ����Ӧ���ǽ����ǻ�����Ϊȩ��������GΪ ��
��
��5����(CH3)2SO4��Ŀ�ıȽ�������Ϊ�˽����ǻ���H���ɼ�����B��C�õ�������Fe��HCl��������ԭΪ��������D��E���Եõ���̼�����������������±�����Ͱ�������ȡ�����������ϵ�H�����������������Ϸ������Ϳ��Եõ��ϳɷ�����


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�����Ϊ��������ȱ�������涨��ʳ���б�����������ĵ���ء�����ʳ�����Ƿ�ӵ⣬���������·�Ӧ��
KIO3+ KI+ H2SO4�T K2SO4+ I2 + H2O
��1����ƽ�÷���ʽ��������˫���ŷ���ʾ�÷���ʽ����ת�Ƶķ�������Ŀ��____________________
��2���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ______________��
��3�������Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaClO2��һ����Ҫ��ɱ����������Ҳ������Ư��֯��ȣ���һ�������������£��ش��������⣺
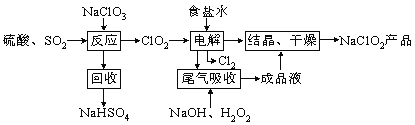
��1��ClO2�ķе�Ϊ283K����ClO2�ֽⱬը��һ����ϡ����������ϡ�͵�10%���¸���ȫ��д������Ӧ������������ClO2�Ļ�ѧ����ʽ ��
��2����β��������������������������ų�������ClO2��
����β�����չ����У��ɴ���H2O2���Լ��� �����������
A��Na2O2 B��Na2S C��FeCl2 D��KMnO4
�����β��������Ч�ʵĿ��д�ʩ�� �����������
A��β������ʱ��ֽ�������Һ B���ʵ��ӿ�β����ͨ������
C�����¶ȿ�����20������ D����ˮϡ��β������Һ
�������շ�Ӧ�У��������뻹ԭ�������ʵ���֮��Ϊ ��
��3���ڼ�����Һ��NaClO2�Ƚ��ȶ�����������Һ�У�ClO2-��H+���ΪHClO2��HClO2��Ψһ����±�ᣬ���ȶ����ֽ����Cl2��ClO2��H2O��д��HClO2�ֽ�Ļ�ѧ����ʽ�� ��
��4����֪NaClO2���ܽ�����¶����߶�����NaClO2������Һ��38������60�����»�����NaClO2����NaClO2���������п��ܻ��е������� ���ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯����ͨ��һ����ѧ��Ӧʵ�ֵ���( )
A.BaCl2��BaSO4B.CuO��Cu(OH)2
C.NaOH��Na2CO3D.MgSO4��Mg(OH)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
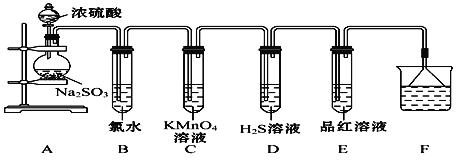
����Ŀ��ij��ѧ��ȤС��Ϊ̽��SO2������������ͼ��ʾװ�ý���ʵ�顣(��֪��Na2SO3+H2SO4(Ũ) Na2SO4+SO2��+H2O)
��ش�����������
��1��װ��A��ʢ��Ũ������������Ƶ��������Ʒֱ���________��________��
��2����Ӧ����װ��B�з�����������______________����Ӧ�����ӷ���ʽΪ__________��װ��C�е�������__________��������SO2��__________________��װ��D�е�������__________��������Ӧ�Ļ�ѧ����ʽΪ__________________��
��3��װ��E��Ŀ����̽��SO2��Ʒ����Һ���õĿ���������д��ʵ�����������________________________________________________________________
��4��Fװ�õ�������_________________________������©����������__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��Ӧ�����ӷ���ʽ��д��ȷ����
A. ����̼������Һ��ͨ�������Ķ�����̼��2Na++CO32-+CO2+H2O=2NaHCO3��
B. KIO3��KI��������Һ�з�Ӧ��5I-+IO3-+3H2O�T3I2+6OH-
C. ��Al2(SO4)3��Һ�м�������İ�ˮ��Al3++4NH3��H2O�TAlO2-+4NH4++2H2O
D. ����ʯ��ˮ�������Һ��ϣ�Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NOx��SO2��CO�ȴ�����Ⱦ����Ĵ�������������Ҫ���壬��ش��������⣺
��1��һ�������£���һ���������ܱ������г���2mol SO2��1mol O2������Ӧ��������˵����ȷ���� ��
A.����Ӧ����v��SO2����v��SO3���������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
B.�����¶Ⱥ�����������䣬����2mol N2 �� ��ѧ��Ӧ���ʼӿ�
C.ƽ��������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�����Ӧ���ת����һ��������
D.ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ�������
E.�����¶Ⱥ�����������䣬ƽ����ٳ���2mol SO3 �� �ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�
F.ƽ��������¶ȣ�ƽ�ⳣ��K����
��2����ij�¶��£�SO2��g��+ ![]() O2��g��SO3��g����H=��98kJ/mol����ʼʱ��100L���ܱ������м���4.0mol SO2��g����10.0mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�196kJ�����������¶��µ�ƽ�ⳣ��K=���÷�����ʾ�����ڸ��¶��£��ֱ�0.2mol/L ��SO2 ��0.1mol/L O2����̶�������ܱ������У���SO2ת����Ϊ60%ʱ���÷�Ӧ���������
O2��g��SO3��g����H=��98kJ/mol����ʼʱ��100L���ܱ������м���4.0mol SO2��g����10.0mol O2��g��������Ӧ�ﵽƽ��ʱ���ų�196kJ�����������¶��µ�ƽ�ⳣ��K=���÷�����ʾ�����ڸ��¶��£��ֱ�0.2mol/L ��SO2 ��0.1mol/L O2����̶�������ܱ������У���SO2ת����Ϊ60%ʱ���÷�Ӧ���������
��3����һ��2L���ܱ������г���һ������SO3������Ӧ������SO3�ı仯����ͼ��ʾ����10 min��ѹ������Ϊ1L����SO3�ı仯����Ϊ����ͼ���е���ĸ��ţ���
��4����ӦN2O4��g��2NO2��g������H=+57kJmol��1 �� ���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����
A.A��C����ķ�Ӧ���ʣ�A��C
B.A��C�����������ɫ��A�Cdz
C.��״̬B��״̬A�������ü��ȵķ���
D.��P2��P1 �� ��ѧƽ�ⳣ��KA��KC
��5����CH4����ԭNOxҲ�������������������Ⱦ�����磺
��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=��574KJ/mol
��CH4��g��+4NO ��g��=2N2��g��+CO2��g��+2H2O��g����H2=��1160KJ/mol
��д��1molCH4��ԭNO2����N2��CO2��H2O��̬���ʵ��Ȼ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ļ�����A��������ת����ϵ:

��֪BΪ����ɫ���嵥�ʡ��������������:
��1��A�Ļ�ѧʽ________��
��2����C����Һ�еμ�����KSCN��Һ,����������,�ٵμӼ���B��ˮ��Һ,��Һ��Ѫ��ɫ�� �����ӷ���ʽ��ʾ�ù���________��________��
��3����DΪ����,��D�Ļ�ѧʽ________ (д��2��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ϩ��˵����ȷ����
A������Ȼ������Ҫ�ɷ� B����ʹ������Ȼ�̼��Һ��ɫ
C�����ܷ���ȼ�շ�Ӧ D�����ܷ����Ӿ۷�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com