
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。(已知:Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O)
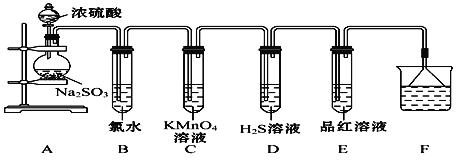
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是________、________。
(2)反应后,装置B中发生的现象是______________,反应的离子方程式为__________;装置C中的现象是__________,表现了SO2的__________________;装置D中的现象是__________,发生反应的化学方程式为__________________。
(3)装置E的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象________________________________________________________________
(4)F装置的作用是_________________________,倒扣漏斗的作用是__________
【答案】 分液漏斗 圆底烧瓶 溶液褪色 SO2+Cl2+2H2O4H++2Cl-+ SO42- 溶液紫色褪去(溶液褪色) 还原性 有黄色沉淀生成 2H2S+SO23S↓+2H2O 将试管E在酒精灯上加热,溶液恢复红色 吸收多余的SO2 防止倒吸
【解析】(1)根据仪器构造可判断,装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是分液漏斗、圆底烧瓶;(2)二氧化硫中硫元素是+4价,处于中间价态,既有还原性,又有氧化性,氯气为黄绿色的气体,其溶液为浅黄绿色,具有强氧化性,能氧化二氧化硫中+4价的硫,生成硫酸和盐酸,溶液褪色,反应方程式为SO2+Cl2+2H2O=4H++2Cl-+SO42-;酸性高锰酸钾有强氧化性,也能氧化二氧化硫中+4价的硫,所以二氧化硫能被酸性高锰酸钾溶液氧化而褪色,同时说明二氧化硫有还原性;硫化氢中的硫为-2价,与二氧化硫作用,二氧化硫表现为氧化性,被还原成0价的硫,反应方程式为2H2S+SO2=3S↓+2H2O;(3)二氧化硫具有漂白性,能使品红溶液褪色,但其漂白性不稳定,加热褪色后的品红溶液,溶液的颜色能复原,因此实验操作及现象为将试管E在酒精灯上加热,溶液恢复红色;(4)二氧化硫是大气污染物,需要尾气处理,则F装置的作用是吸收多余的SO2;1体积水中能溶解40体积的二氧化硫,倒扣的漏斗具有缓冲作用,能防止倒吸。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】阅读下文,回答问题。
甲烷是天然气、沼气、油田气和煤矿坑道气的主要成分,世界20%的能源需求由它提供。
甲烷是重要的工业原料。甲烷高温分解可得炭黑,常用作颜料、油墨、油漆以及橡胶的添加剂;甲烷还是乙炔、氢氰酸及甲醛等重要物质制备的原料;甲烷还可以制取氯仿(三氯甲烷)和四氯化碳等有机溶剂。
天然气中除甲烷外,另有少量的乙烷、丙烷和丁烷,还有硫化氢、二氧化碳、氮气、水汽和少量一氧化碳等。丙烷俗称“高能气”,2008年北京奥运祥云火炬就是用丙烷作为燃料的。丙烷价格低廉,可燃温度范围宽,燃烧火焰呈亮黄色易识别,燃烧产物无污染。它是一种清洁燃料,特别符合“绿色奥运”的理念。天然气中另一种成分丁烷也有重要用途,可用作冷冻剂和气体打火机燃料,也是制取多种有机物的重要原料。
目前沼气在我国农村也有着广泛的应用。人们在一定的温度、湿度、pH条件下,将秸秆、杂草、人畜粪便等堆积在发酵池中,经隔绝空气发酵产生沼气。现在我国农村通过修建沼气池,不但增加了高效清洁燃料,改善了农村居住环境,而且发酵池中还可以产生优良的液体肥料,一举多得。

(1)天然气中除含甲烷外,还含有______________________________________等有机物。
(2)甲烷高温分解得到炭黑的化学方程式是______________________________________。
(3)氯仿的结构式是______________________________。
(4)北京奥运火炬选择丙烷作气体燃料的原因是______________(填序号)。
a.可燃温度范围宽 b.价格低廉
c.燃烧产物没有污染 d.燃烧的火焰颜色易识别
(5)乙烷与氯气生成一氯乙烷的化学方程式是____________________________________。
(6)下列说法正确的是______________(填序号)。
a.煤矿坑道中严禁明火
b.丁烷可作气体打火机的燃料
c.发酵池中只产生沼气
d.发酵池中可利用的原料有秸秆、杂草、人畜粪便等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g) + 3H2(g)![]() 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。

(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N20.672 L(标准状况),则需要消耗0.3mol·L-1的NaClO溶液 L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。

③用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 molL-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:

(1)图中A点表示沉淀其物质的量是________
(2)反应至A点时消耗NaOH溶液的体积为_______
(3) AlCl3溶液的浓度为________
(4)假设溶液中有0. 39克Al(OH)3沉淀,则此时用去NaOH溶液体积为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解质溶液的正确判断是( )
A.在pH=12的溶液中,K+、Cl﹣、HCO3﹣、Na+可以共存
B.水电离的c(H+)=1×10﹣3mol/L的溶液中:Na+、Fe3+、SO42﹣、Cl﹣
C.由0.l moI/L BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH﹣
D.![]() =1×10﹣13mol/L 的溶液中:Ba2+、ClO﹣、Cl﹣、NO3﹣
=1×10﹣13mol/L 的溶液中:Ba2+、ClO﹣、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
用于合成-分泌调节剂的药物中间体的化合物H,其合成路线流程图如图:
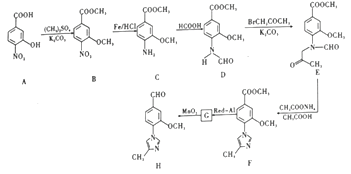
回答下列问题:
(1)B中的含氧官能团名称为____________、______________ 、___________________。
(2)B→C的反应类型为_________________。
(3)写出同时满足下列条件的B的一种同分异构体的结构简式:___________________。
①含有苯环,且分子中有一个手性碳原子;②能发生水解反应,其中一种水解产物分子中只有2种不同化学环境的氢,且峰面积之比为2:1。
(4)G的分子式为C12H14N2O2,经氧化得到H,写出G的结构简式:_____________。
(5)依据合成路线中的信息,请写出以![]() 、
、![]() 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备![]() 的合成路线流程图_________________________________(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_________________________________(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10molL﹣1的标准NaOH溶液滴定未知浓度的盐酸,取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂.重复上述滴定操作2~3 次,记录数据如下.
(1)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 .
A.滴定前平视读数,终点读数时仰视读数
B.锥形瓶水洗后未用用标准盐酸润洗
C.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
D.标准液漏滴在锥形瓶外一滴
E.滴定前仰视读数,终点滴定后俯视读数
F.碱式滴定管尖嘴部分有气泡,滴定后消失
(2)若在达到滴定终点时,不慎多加了一滴NaOH溶液(一滴溶液体积约为0.05mL)继续加水到50mL,所得溶液的PH为
(3)如图是向20mL的盐酸中逐渐加入0.1mol/L NaOH溶液时,溶液的pH变化图象,当滴加NaOH溶液为10mL时,该混合液的PH= , (含Lg表达式),若用该NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是
A.溶液呈中性,可选用甲基橙或酚酞作指示剂 B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂 D.溶液呈碱性,只能选用酚酞作指示剂
(4)氧化还原滴定﹣﹣取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1molL﹣1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O.表格中记录了实验数据:
数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 23.40 |
第二次 | 25.00 | 4.00 | 23.90 |
第三次 | 25.00 | 5.00 | 25.10 |
①滴定时,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 无论乙烯的加成,还是乙烷的取代反应都可制得氯乙烷
B. 使用溴水或酸性高锰酸钾溶液都可以除去乙烷中的乙烯杂质
C. 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D. 乙烯的化学性质比乙烷的化学性质活泼
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com