
下列各组物质的分离、提纯或除杂,可采用相同的原理和操作方法的是( )
A.除去苏打中混有的小苏打杂质;分离氯化钠固体中混有的碘单质
B.除去粗食盐中的泥沙;除去氯化钾中的二氧化锰
C.分离硝酸钾与氯化钠;除去氢氧化铁胶体中混有的氯化钠
D.除去二氧化碳中混有的少量二氧化硫;除去二氧化碳中混有的少量一氧化碳
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.C、N、O三种元素第一电离能从大到小的顺序是O>N>C
B.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
C.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
D.Ni原子的核外电子排布式为1s22s23s23p63d84s2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①最外层电子数是2的元素一定是金属元素
②元素周期表中,非金属性最强的元素是F
③盐酸是强酸,H2S是弱酸,故非金属性:Cl>S
④X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则原子序数:X>Y
⑤O2和O3属于同素异形体,故它们的性质相同
⑥H2O稳定的原因是水分子间存在氢键
A.①④⑥ B.①③⑤ C.①③⑤⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2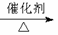 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的电子式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型:① ,② ,④ 。
(4)写出下列反应的化学方程式:
② ;④ 。
(5)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
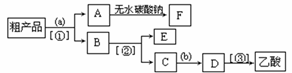

(Ⅰ)试剂a是__________,试剂b是_______________;
分离方法①是_________________,分离方法②是__________________,
分离方法③是_______________。
(Ⅱ)写出C → D 反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:
猜想Ⅰ:甲酸具有酸性
实验Ⅰ:在甲酸溶液中滴加紫色石蕊试液
猜想Ⅱ:甲酸能发生酯化反应
实验Ⅱ:[装置如图(1)所示]
猜想Ⅲ:甲酸能发生银镜反应
实验Ⅲ:[步骤如图(2)所示]
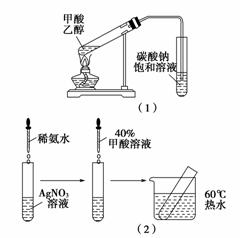
问题Ⅰ:请你进一步设计实验证明甲酸是强酸还是弱酸:______________________________________________。
问题Ⅱ:实验Ⅱ能验证猜想Ⅱ吗?________;如能,请说明你的理由;如不能,请指出实验Ⅱ中的错误__________________________________________________。
问题Ⅲ:分析甲酸的结构,实验Ⅲ中没有出现任何现象的可能原因是_______________________________。
问题Ⅳ:请你在仔细分析甲酸的组成和结构的基础上,再提出一个关于甲酸性质的猜想并设计实验方案验证你的猜想:
(1)你提出的猜想是______________________。
(2)你设计的实验方案是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)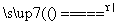 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
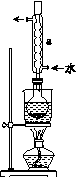
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O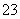 +I2===S4O
+I2===S4O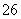 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
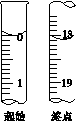
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO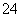 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是( )
A.晶体硅熔点高硬度大,可用于制作半导体材料
B.氢氧化铝具有弱碱性,可用于制胃酸中和剂
C.漂白粉在空气中不稳定,可用于漂白纸张
D.氧化铁能与酸反应,可用于制作红色涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取
B.用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度
C.氯离子存在时,铝表面的氧化膜易被破坏,因此含盐腌制品不宜直接存放在铝制容器中
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com