
| A. | 1 mol磷酸钾中阴离子所带电荷数为NA | |
| B. | 在18g18O2中含有NA个18O原子 | |
| C. | 0.10mol Fe粉与足量水蒸气反应转移的电子数为0.30 NA | |
| D. | 将0.1mol硅酸钠溶于1L水中,所得溶液中含有0.2NA个Na+ |
分析 A.依据磷酸根离子所带电荷分析判断;
B.依据氧原子的质量数结合质量计算元素物质的量;
C.铁与水蒸气反应生成四氧化三铁.铁元素化合价不是+3价;
D.1mol硅酸钠电离生成2mol钠离子.
解答 解:A.1个磷酸根离子带电荷为三个,1 mol磷酸钾中阴离子所带电荷数为3NA,故A错误;
B.18g18O2中氧原子物质的量为1mol,含有NA个18O原子,故B正确;
C.铁和水蒸气反应生成的是四氧化三铁,铁元素化合价为$\frac{8}{3}$价,故C错误;
D.1mol硅酸钠电离生成2mol钠离子,0.1mol硅酸钠含有0.2NA个Na+,故D正确;
故选BD.
点评 本题考查了阿伏伽德罗常数的应用,主要考查质量换算物质的量计算微粒数,铁与水蒸气的反应产物化合价的判断,盐类水解的应用,题目难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
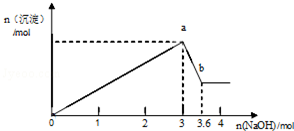 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5g甲基所含有的电子数是NA | |
| B. | 28g乙烯所含共用电子对数目为6NA | |
| C. | 17g羟基所含有的电子数是10NA | |
| D. | 标准状况下,2.24 LCCl4中含Cl原子数目等于0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
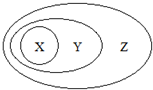 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | CuSO4•5H2O | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 碱性氧化物 | 氧化物 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{b-2c}{a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-2c}{a}$ | D. | $\frac{2b-4c}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com