
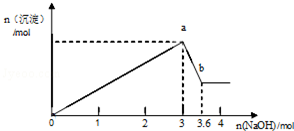
 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.分析 FeCl3、AlCl3的混合溶液中加入氢氧化钠溶液,先发生的反应(oa段):Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,当沉淀达到最大量后发生反应(ab):Al(OH)3+OH-═AlO2-+2H2O,据此结合图中消耗的NaOH的物质的量进行解答.
解答 解:FeCl3、AlCl3的混合溶液中加入氢氧化钠溶液,先发生的反应(oa段):Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,当沉淀达到最大量后发生反应(ab):Al(OH)3+OH-═AlO2-+2H2O,
(1)根据分析可知,a点生成的沉淀为Fe(OH)3和Al(OH)3,
故答案为:Fe(OH)3和Al(OH)3;
(2)ab段氢氧化铝开始溶解,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)设FeCl3、AlCl3的物质的量分别为x、y,
0~a段反应,消耗NaOH溶液3mol
Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓,
1mol 3mol 1mol 3mol 1mol
x 3x y 3y y
3x+3y=3mol①
a~b段反应,消耗NaOH溶液(3.6-3)mol
Al(OH)3+OH-═AlO2-+2H2O
1mol 1mol
y y
y=0.6mol②
由①②解得x=0.4mol,
即FeCl3的物质的量为0.6mol,c=$\frac{0.4mol}{0.1L}$=4mol/L,
答:原混合液中FeCl3的物质的量浓度为4mol/L.
点评 本题考查了混合物反应、离子反应的计算,题目难度中等,明确图象曲线变化对应反应原理为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸时,先产生沉淀又溶解 | |
| B. | 都能透过半透膜 | |
| C. | 加热、蒸干、灼烧,最终都有Fe2O3生成 | |
| D. | 都有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol-1、2C(s)+O2(g)=2CO(g)△H=bkJ•mol-1,则a>b | |
| D. | 已知P(红磷,s)═p(白磷,s)△H>0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH+H2O═NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 氯水中加入红色鲜花,红花褪色,说明溶液中有Cl2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol磷酸钾中阴离子所带电荷数为NA | |
| B. | 在18g18O2中含有NA个18O原子 | |
| C. | 0.10mol Fe粉与足量水蒸气反应转移的电子数为0.30 NA | |
| D. | 将0.1mol硅酸钠溶于1L水中,所得溶液中含有0.2NA个Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com