
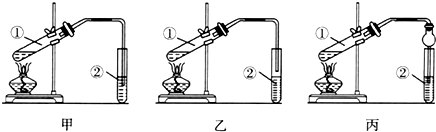
分析 (一)乙酸和乙醇易溶于水,导管口在饱和碳酸钠溶液液面上,而不插入液面下是为了防止倒吸,球形干燥管导气的同时也起到防倒吸作用;
(二)a.实验前,要检查装置的气密性;
b.乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水;
c.实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体;碱性环境下,酯能够发生水解反应;
d.互不相溶的液体可以用分液法分离;
e.依据方程式:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O计算解答.
解答 解:(一)乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用;
故答案为:乙;防止倒吸;
(二)a.实验前,要检查装置的气密性;
故答案为:装置的气密性;
b.乙酸和乙醇在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,化学方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
c.实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体;所以饱和碳酸钠作用:吸收乙醇;除去乙酸;降低乙酸乙酯的溶解度,使其分层析出;
若用NaOH溶液,则NaOH会中和CH3COOH而使生成的乙酸乙酯又彻底水解,导致实验失败,所以不能用氢氧化钠吸收;
故答案为:吸收乙醇;除去乙酸;降低乙酸乙酯的溶解度,使其分层析出 不能 若用NaOH溶液,则NaOH会中和CH3COOH而使生成的乙酸乙酯又彻底水解,导致实验失败;
d.用饱和碳酸钠溶液吸收乙酸乙酯,得到两种液体互不相溶,可以用分液法分离;
故答案为:分液;
e.若60g乙酸与足量的乙醇反应能生成53 g乙酸乙酯,则:
CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
60g 88g
x 53g
解得x=36,14g;
反应的转化率为:$\frac{36.14g}{60g}$×100%=60%;
故答案为:60%.
点评 本题考查了实验室制备乙酸乙酯,明确反应原理及实验注意事项是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的主要原料是石墨,儿童使用时不会引起中毒 | |
| B. | CO有毒,生有煤炉的居室可放置数盆清水,能有效地吸收CO,防止煤气中毒 | |
| C. | “汽水”浇灌植物有一定的道理,其中CO2的释放,有利于植物的光合作用 | |
| D. | 硅的提纯与应用,促进了半导体元件与集成芯片业的发展,可以说“硅是信息技术革命的催化剂” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中充分燃烧时先熔化再燃烧,最后所得的产物只有Na2O2 | |
| B. | 金属钠不能保存在密闭容器中,应保存在煤油中 | |
| C. | 铝制品在生活中非常普遍,是因为铝的化学性质不活泼 | |
| D. | 铁在潮湿的空气中形成的氧化物疏松,不能保护内层金属,故铁制品往往需涂保护层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应放出大量的热,甲烷可用作气体燃料 | |
| B. | 如温度超过100℃,反应前后气体的体积不变 | |
| C. | 可用干燥的冷烧杯检验生成的产物为CO2和H2O | |
| D. | 此式中使用箭头表示此反应主产物为CO2和H2O,还可能有其他副产物如CO、C等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
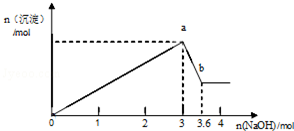 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
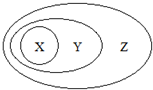 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )| X | Y | Z | |
| A | CuSO4•5H2O | 盐 | 纯净物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 碱性氧化物 | 氧化物 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com