
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 |
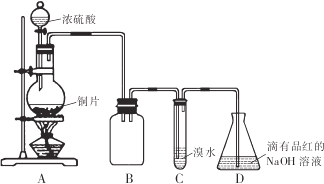
分析 由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气,
(1)B仪器可防止倒吸;
(2)C中发生的反应中S元素的化合价升高;装置D中NaOH全部转化为NaHSO3时碱性降低;
(3)②NaClO可氧化KI;
③溴水可氧化HSO3-;
④HSO3-与高锰酸钾可发生氧化还原反应;
(4)电离显酸性,水解显碱性,则测定pH即可.
解答 解:由图可知,A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸,C中发生SO2+Br2+2H2O=H2SO4+2HBr,D中NaOH溶液吸收尾气,
(1)装置B的作用是防倒吸(或安全瓶),故答案为:防倒吸(或安全瓶);
(2)C中发生的反应中S元素的化合价升高,则设计装置C的目的是验证SO2的还原性,装置C中发生反应的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-.装置D中NaOH全部转化为NaHSO3时碱性降低,装置D中NaOH全部转化为NaHSO3的标志是溶液由红色变为无色,
故答案为:还原;SO2+Br2+2H2O=4H++SO42-+2Br-;溶液由红色变为无色;
(3)②NaClO可氧化KI,则观察到溶液变为蓝色;
③溴水可氧化HSO3-,则观察到溴水褪色,
④HSO3-与高锰酸钾可发生氧化还原反应,由溶液为紫色可知,不存在HSO3-,则I或Ⅲ成立,
故答案为:
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | 溶液变为蓝色 | Ⅲ |
| ③ | 滴加少量溴水,振荡 | 溴水褪色 | Ⅱ |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 | I或Ⅲ |
点评 本题考查制备实验方案的设计,为高频考点,把握制备实验装置、原理、物质的性质及反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | pH=1的溶液:NH4+、Al3+、SO42-、Br- | |
| C. | 0.1 mol•L-1FeCl3溶液:NH4+、H+、I-、SCN- | |
| D. | 常温下,在c(H+)水•c(OH-)水=10-26的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol-1、2C(s)+O2(g)=2CO(g)△H=bkJ•mol-1,则a>b | |
| D. | 已知P(红磷,s)═p(白磷,s)△H>0,则白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH+H2O═NaOH+H2↑ | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③④ | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气的水溶液可以导电,说明氯气是电解质 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 | |
| D. | 氯水中加入红色鲜花,红花褪色,说明溶液中有Cl2存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
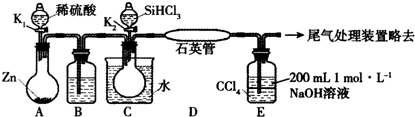
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com