
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ•mol-1则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量 | |
| C. | 己知2C(s)+2O2(g)═2CO2(g)△H=akJ•mol-1、2C(s)+O2(g)=2CO(g)△H=bkJ•mol-1,则a>b | |
| D. | 已知P(红磷,s)═p(白磷,s)△H>0,则白磷比红磷稳定 |
分析 A、燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,应生成液态水;
B、醋酸是弱酸,电离过程需要吸热,据此回答;
C、一氧化碳燃烧生成二氧化碳是放热反应,焓变为负值,据此比较大小;
D、物质具有的能量越低越稳定,吸热反应,产物的能量高于反应物的能量,据此回答.
解答 解:A、燃烧热是指可燃物完全燃烧生成稳定化合物时放出的热量,氢气燃烧热应生成液态水,故A错误;
B、醋酸是弱酸,电离过程需要吸热,含40.0g即1molNaOH的稀溶液与稀醋酸完全中和,放出小于57.3kJ的热量,故B正确;
C、一氧化碳燃烧生成二氧化碳是放热反应,即碳完全燃烧生成二氧化碳放出的热量多,焓变为负值,比较大小,则a<b,故C错误;
D、已知P(红磷,s)═p(白磷,s)△H>0,产物白磷的能量高于反应物的能量,红磷比白磷稳定,故D错误.
故选B.
点评 本题考查了燃烧热、中和热概念的分析,物质稳定性和能量高低有关,注意焓变为负值,题目较简单.


科目:高中化学 来源: 题型:解答题
 已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.
已知T、X、Y、Z、Q是中学化学常见的五种元素,其中T、X、Y、Z的信息如表.| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p电子数. |
| X | 元素的原子半径是第三周期主族元素中最大的. |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的. |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中充分燃烧时先熔化再燃烧,最后所得的产物只有Na2O2 | |
| B. | 金属钠不能保存在密闭容器中,应保存在煤油中 | |
| C. | 铝制品在生活中非常普遍,是因为铝的化学性质不活泼 | |
| D. | 铁在潮湿的空气中形成的氧化物疏松,不能保护内层金属,故铁制品往往需涂保护层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
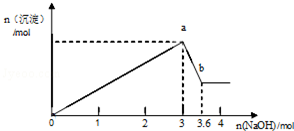 现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
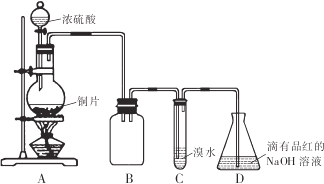
| 序号 | 实 验操作 | 现 象 | 结 论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | Ⅲ | |
| ③ | 滴加少量溴水,振荡 | Ⅱ | |
| ④ | 滴加少量酸性KMn04溶液、振荡 | 溶液为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.75 g | B. | 4.05g | C. | 2.70 g | D. | 1.80 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com