
【题目】下列说法正确的是
A. Na2O2中阴阳离子的的个数比为1∶1
B. 元素周期表中,包含元素种数最多的族是第ⅢB族
C. NaCl和HCl气化时,克服作用力完全相同
D. 金属化合物一定是离子化合物,不含金属元素的化合物有可能是离子化合物
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)X在元素周期表中的位置为____;画出X的简单离子结构示意图____。已知X元素的一种原子,其中子数为10,写出这种原子的原子符号_______。
(2)四种元素简单离子的半径由大到小为______(用离子符号表达)。
(3)W、X的最简单氢化物稳定性为____>____(填化学式)。
(4)Z最高价氧化物的水化物与Y最高价氧化物对应水化物反应的化学方程式为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另—个盛有H2和Cl2的混合气体。在同温同压下, 两容器内的气体一定具有相同的( )
A. 原子数 B. 密度 C. 质量 D. 质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的方程式正确的是
A. 碳酸钠溶液呈碱性:CO32— + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. 氢氧化亚铁在空气中变质:2Fe(OH)2+O2+2H2O = 2Fe(OH)3
C. 铜片溶于稀硝酸产生无色气体:Cu+4H++2NO3—=Cu2++2NO2↑+2H2O
D. 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-=2AlO2-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答问题:
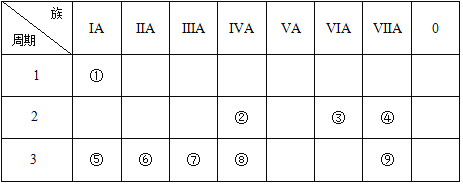
(1)表中用于半导体材料的元素在周期表中的位置__________。
(2)③、④、⑧的原子半径最小是__________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答)。
(5)②和③按原子数1:2形成的化合物的电子式为____,该晶体气化的过程中克服的微粒间作用力为______。
(6)③和⑧形成的化合物属于__________(填“离子化合物”或“共价化合物”),该晶体属于__________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关焰色反应的说法正确的是
A. 焰色反应是金属单质表现的性质
B. 焰色反应是因为发生了化学变化而产生的
C. 焰色反应看到黄色火焰并不能确定该物质一定不含钾元素
D. 洗涤焰色反应中用到的铂丝可用稀硫酸代替稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应2X(g)![]() Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。
Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(molL-1)随反应时间(min)的变化情况如图所示。

下列说法不正确的是
A. 比较实验②、④得出:升高温度,化学反应速率加快
B. 比较实验①、②得出:增大反应物浓度,化学反应速率加快
C. 若实验②、③只有一个条件不同,则实验③使用了催化剂
D. 在0~10min之间,实验②的平均速率v(Y)=0.04molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
CO(g)+H2(g)。可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A. 体系的压强不再发生变化
B. 2v正(CO)=v逆(H2O)
C. 生成n molCO的同时生成n mol H2
D. 1 mol H-H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分。
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):属于电解质的是______,属于非电解质_______。
(2)过量②的水溶液与⑦反应的离子方程式______________________。
(3)某同学用⑤和浓硫酸共热来制备⑥,化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①请用单线桥标出电子转移的情况____________;
②浓H2SO4表现出来的性质是:_______;当电子转移0.1mol时,消耗氧化剂的物质的量为_______。
(4)如图表示某同学配制480mL 0.5mol/L 的NaOH溶液的部分操作示意图,其中有错误的是_______,这样操作所配制的溶液比要求的浓度要_________ (填“偏高”、“偏低”、“不影响”)。配制应称取NaOH________g。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com