
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
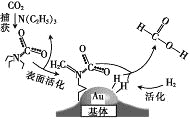
A. 标准状况下,22.4L CO2中所含的电子数目为16NA
B. 10.1g N(C2H5)3中所含的非极性共价键数目为0.3NA
C. 2mol Au与2mol H2中所含的分子数目均为2NA
D. 100g 46%的甲酸水溶液中所含的氧原子数目为5NA
【答案】BD
【解析】
A.在标准状况下,22.4L CO2的物质的量是1mol,由于CO2分子中含有22个电子,所以1mol CO2的中所含的电子数目为22NA,A错误;
B.N(C2H5)3分子中含有3个非极性共价键,10.1g N(C2H5)3的物质的量是0.1mol,所以其中含有的非极性共价键数目为0.3NA,B正确;
C.Au是由原子构成,无分子,因此该选项说法不合理,C错误;
D.100g 46%的甲酸水溶液中含有甲酸质量是46g,物质的量其物质的量是1mol,其中含有2mol O 原子;含有H2O的质量是54g,H2O的物质的量是3mol,其中含有3mol O原子,因此100g该溶液中所含的氧原子数目为5NA,D正确;
故合理选项是BD。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.
(1)A的结构简式为___________; A中的碳原子是否都处于同一平面?____(填“是”或“不是”);
(2) 在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体.

反应②的化学方程式为__________________________;E2的结构简式是___________________;④、⑥的反应类型依次是________________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3与浓盐酸在一定温度下反应会生成黄绿色的易爆物质二氧化氯,其变化可表述为:KClO3+HCl(浓)―KCl+ClO2↑+Cl2↑+
(1)请完成该化学方程式(将配平后的完整化学方程式写在答题卡上)。___
(2)浓盐酸在反应中显示出来的性质是___(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若产生7.1gCl2,则生成ClO2的质量为___g。
(4)ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(用单位质量得到的电子数表示)是Cl2的___倍(小数点后保留两位数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1) 除去KNO3中混有的SO42-应选择的除杂试剂为__________;
(2) 向沸腾的蒸馏水中滴加饱和FeCl3溶液可制取Fe(OH)3胶体,用化学方程式表示该方法的原理:_______;
(3) 在水溶液中,KHSO4的电离方程式为:______________________________;
(4) 盐酸与氢氧化钠溶液反应的离子方程式为:__________________________;
(5) CO2与足量澄清石灰水反应的离子方程式:__________________________;
(6) 硫酸铜溶液与氢氧化钡溶液反应的离子方程式为:____________________ ;
(7)小苏打常作为食品制作过程中的膨松剂,其溶液与稀HNO3反应的离子方程式为:___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:
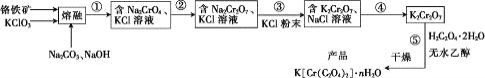
回答下列问题:
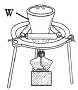
(1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为_______________。
(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________,“调pH为7~8,加热煮沸半小时”的目的是__________。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为________。
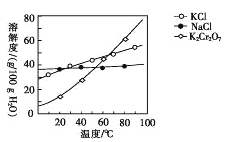
(4)步骤④包含的具体操作有____,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
(5)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。
(6)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g) △H<0的影响如图所示,下列说法正确的是( )
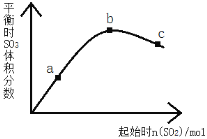
A. 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行
B. a、b、c三点中,a点时SO2的转化率最高
C. 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D. a、b、c三点的平衡常数Kb>Kc>Ka
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com