
| A. | 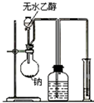 测量钠与乙醇反应生成H2的体积 | B. | 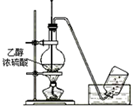 制取乙烯 | ||
| C. | 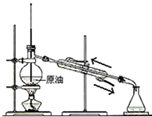 蒸馏石油 | D. | 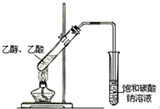 制取乙酸乙酯 |
分析 A.用排水法收集气体,进气管应短进长出;
B.实验室制备乙烯,加热到170℃,温度计测量反应液的温度;
C.温度计位置以及水的进出方向错误;
D.缺少浓硫酸,且应防止倒吸.
解答 解:A.用排水法收集气体,进气管应短进长出,否则不能测量气体的体积,故A错误;
B.实验室制备乙烯,加热到170℃,温度计测量反应液的温度,可完成实验,故B正确;
C.温度计位置应位于蒸馏烧瓶的支管口附近,冷凝水应从下口进,上口出,故C错误;
D.反应在浓硫酸催化条件下进行,否则不能生成乙酸乙酯,且导管不能插入液面以下,防止倒吸,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的体积测量、气体的制备、物质的分离、收集等知识点,难度不大,注意把握实验的严密性和合理性的评价.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,11.2L的CHCl3所含的分子数为0.5NA | |
| B. | 17g羟基(-OH)所含有的电子数是10NA | |
| C. | 9.2g甲苯和丙三醇的混合物中,含氢原子数目为0.8NA | |
| D. | 现有乙烯、丙烯的混合气体共28g,其中碳原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉互为同分异构体 | |
| B. | 油脂发生皂化反应可生成脂肪酸和丙醇 | |
| C. | 酯类物质是产生水果香味的主要成分 | |
| D. | 糖类、蛋白质都属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象 | 结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量①四氯化碳,振荡后分液.分别取少量②上层溶液于试管A、B中 | ||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; | 溶液分层,下层显④红棕(橙红色也可以)色 | 锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤镁粉. | 有汽泡生成 | 锥形瓶中液体含大量⑥H+ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5 mol•L-1•s-1 | B. | v B=0.5 mol•L-1•s-1 | ||
| C. | vC=0.4 mol•L-1•s-1 | D. | vD=1.2 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||||
| Y | Z | W |
 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com