
【题目】下列离子组在一定条件下能大量共存,且加入相应试剂后所对应的离子方程式正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A |
| 稀硫酸 |
|
B |
| 氢氧化钠溶液 |
|
C |
| 氢氧化钠溶液 |
|
D |
| 过量氢氧化钠溶液 |
|
A. A B. B C. C D. D
【答案】A
【解析】A,Fe2+、NO3-、K+相互间不反应,能大量共存,加入稀硫酸,NO3-表现强氧化性将Fe2+氧化成Fe3+,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,A项正确;B,Fe3+、ClO-均具有氧化性,I-具有还原性,Fe3+、ClO-均能与I-发生氧化还原反应不能大量共存,B项错误;C,Ba2+、HCO3-、Cl-相互间不反应,能大量共存,加入NaOH溶液反应的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O,C项错误;D,Al3+、Cl-、NO3-相互间不反应,能大量共存,加入过量NaOH溶液反应的离子方程式为Al3++4OH-=AlO2-+2H2O,D项错误;答案选A。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】实验室常用锌与稀硫酸反应制取H2 . 欲使产生H2的速率加快,下列措施可行的是( )
A.加水稀释
B.加少量NaOH溶液
C.降低温度
D.锌片改为锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大的发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于
A.揭示了燃烧的本质B.开发了合成氨的生产工艺
C.提出了元素周期律D.提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修:物质结构与性质】
金属钛(22Ti)号称航空材料。回答下列问题:
(1)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为___________,该能级所在能层具有的原子轨道数为_____________。
(2)[Ti(OH)2(H2O)4]2+中的化学键有_____________。
a.σ键 b.π键 c.离子键 d.配位键
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图所示。

化合物甲的分子中采取sp2杂化方式的碳原子个数为__________,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为____________。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4.写出生成TiCl4的化学反应方程式:_______________。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____________,该晶体中Ti原子周围与距离最近且相等的 N原子的个数为___________。已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长为________cm(用含ρ、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:①![]() H=180.5kJ·
H=180.5kJ·![]()
②C和CO的燃烧热(H)分别为-393.5kJ·![]() 和-283kJ·
和-283kJ·![]()
则2NO(g)+2CO(g)=N2(g)+2CO2(g) H=_________kJ·![]()
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
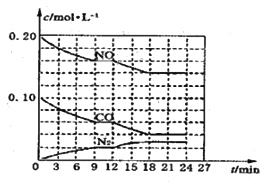
①CO在0—9min内的平均反应速率![]() =__________ mol·L-1·
=__________ mol·L-1·![]() (保留两位有效数字);第12min时改变的反应条件可能为_________。
(保留两位有效数字);第12min时改变的反应条件可能为_________。
A.升高温度 B.加入NO
C.加催化剂 D.降低温度
②该反应在第18min时又达到平衡状态,此时![]() 的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
的体积分数为________(保留三位有效数字),化学平衡常数K=____________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的![]() 转化为HCOOH和
转化为HCOOH和![]() 。已知常温下0.1mol·
。已知常温下0.1mol·![]() 的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
的HCOONa溶液pH=10,则HCOOH的电离常数Ka=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com