
| A、30.1 | B、31.1 |
| C、32.1 | D、33.1 |
| V |
| Vm |
| m |
| n |
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
| 4.48L |
| 22.4L/mol |
. |
| M |
| m |
| M |
| 33.1g |
| 1mol |


科目:高中化学 来源: 题型:
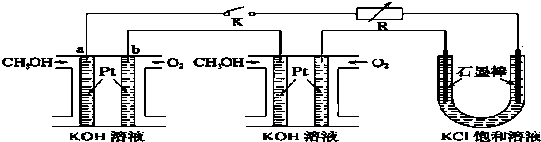
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、禁止使用含铅汽油是为了提高汽油的燃烧效率 |
| B、“白色污染”是指由聚乙烯等塑料垃圾引起的环境污染 |
| C、臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且又不影响水质 |
| D、含有铜、汞、多溴联苯等材料的电子垃圾的任意抛弃会严重污染地下水源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、及时焚烧废弃塑料减少“白色污染” |
| B、工厂用高烟囱排放废气防止“酸雨” |
| C、使用车用乙醇汽油防止“温室效应” |
| D、推广使用无氟冰箱防止“臭氧空洞” |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
A、反应在t1 min内的平均速率为v(H2)=
| ||
| B、保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.30 mol | ||
| C、保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | ||
| D、温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y原子中电子数较X原子多一个,但比Z原子少一个 |
| B、Y单质和Z、X的单质均可以反应 |
| C、元素Z为活泼的金属,其单质跟水反应放出氢气,生成物的水溶液显碱性 |
| D、X原子与氢反应能形成HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com