
【题目】某溶液A加入KSCN溶液后显红色.如果溶液A中加入一种物质B,反应后再加入KSCN溶液,不显红色,则物质B可能是( )
A.硫酸
B.氢硫酸
C.硝酸
D.碘化钾
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-浓度与50 mL 1 mol·L-1AlCl3溶液中Cl-的物质的量浓度不相等的是
A. 50 mL 3 mol·L-1 NH4Cl溶液
B. 150 mL 1 mol·L-1的NaCl溶液
C. 50 mL 3 mol·L-1的KCl溶液
D. 100 mL 1 mol·L-1的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.含有大量Ba2+的溶液中:Cl-、K+、SO42-、CO32-
B.含有大量H+的溶液中:Mg2+、Na+、CO32-、SO42-
C.含有大量OH-的溶液中:Cu2+、NO3-、SO42-、CO32-
D.含有大量H+的溶液中:Cu2+、K+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛和钛合金在航空工业有重要的应用。冶炼钛的过程中发生反应之一是:TiO2+2C+2Cl2===TiCl4+2CO。下列说法错误的是( )
A. 生成1 mol TiCl4时,转移电子4 mol B. C是还原剂
C. 尾气必须净化处理 D. TiO2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( ) 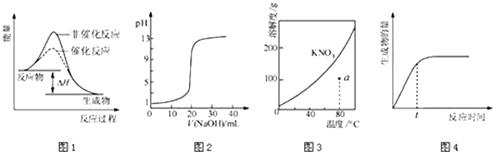
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.可以与H2化合生成液态化合物
D.其原子轨道式为 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | ______________ |
ii. 连好装置一段时间后,向烧杯中滴加 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是_________。
②用化学用语解释实验i中的现象:__________。
(2)查阅资料: ![]() 具有氧化性。
具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
|
| iii. 蒸馏水 | 无明显变化 |
iv. 1.0 | 铁片表面产生大量蓝色沉淀 | ||
v. | 无明显变化 |
a. 以上实验表明:在__________条件下, 溶液可以与铁片发生反应。
b. 为探究![]() 的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后
的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后
再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明![]() 的作用是_________。
的作用是_________。
(3)有同学认为上述实验仍不严谨。为进一步探究![]() 的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是________(填字母序号)。
的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、 | 产生蓝色沉淀 |
B | 酸洗后的铁片、 | 产生蓝色沉淀 |
C | 铁片、 | 产生蓝色沉淀 |
D | 铁片、 | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂,设计能证实铁发生了电化学腐蚀的实验方案__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和Cl2的漂白性,设计了如下的实验装置。

(1)实验室常用软锰矿(主要成分是MnO2)与浓盐酸混合加热的方法制备Cl2,写出实验室制备氯气的化学方程式:________________________________________________。在此化学反应中,氧化剂与还原剂的物质的量之比为____________;若反应过程中转移电子的物质的量为6 mol,则生成氯气的物质的量为____________mol。
(2)反应开始一段时间后, B、D两个试管中的品红溶液出现的现象是: B:_______________________; D:________________________;
(3)停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别是:B:_______________________; D:________________________;
(4)实验中NaOH溶液的作用是________________________________________。若将C中NaOH溶液换成水,当通入物质的量比为1:1的SO2和Cl2,恰好反应生成两种强酸(其中一种是含氧酸,另一种是无氧酸),该反应的化学方程式是:_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com