
�����й��������жϻ��ʾ������ȷ���ǣ� ��
| A�����������������������ֱ���ȫȼ�գ����߷ų��������� |
B����C(ʯī) �� C(���ʯ) Q Q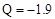 kJ����֪ʯī�Ƚ��ʯ���ȶ� kJ����֪ʯī�Ƚ��ʯ���ȶ� |
C����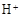 (aq) (aq) (aq) �� H2O(l) (aq) �� H2O(l) Q Q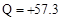 kJ����֪����1mol CH3COOH��ϡ��Һ�뺬1mol NaOH��ϡ��Һ��ϣ��ų���������57.3 kJ kJ����֪����1mol CH3COOH��ϡ��Һ�뺬1mol NaOH��ϡ��Һ��ϣ��ų���������57.3 kJ |
D��2gH2��ȫȼ������Һ̬ˮ�ų�285.8kJ������������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2(g) O2(g) �� 2H2O(l) O2(g) �� 2H2O(l) Q�� Q��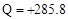 kJ kJ |
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��20g Ba��OH��2��8H2O������10 g NH4Cl����һ�����С�ձ��У����ձ����ڵ���3��4��ˮ�IJ���Ƭ�ϣ��ò�����Ѹ�ٽ��衣������˵����ȷ����
| A��ʵ���в������������Ǽ��ٹ����ܽ� |
| B������Ƭ�Ͻ������С�ձ�ճ��һ��˵���÷�Ӧ�Ƿ��ȷ�Ӧ |
| C����ȡ��Ӧ�������Ķ��ٻ�Ӱ�췴Ӧ�����ȣ����Ƿ��� |
| D���÷�Ӧ�У���Ӧ���������С��������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���������ֳ�����ͬ�������壺��б�����������֪���³�ѹ�£�
�� S (s����б)+O2 (g)��SO2 (g)+297.16kJ��
�� S (s������)+O2 (g)��SO2 (g)+296.83kJ
����˵����ȷ����
| A�����³�ѹ�µ�б����������ȶ� |
B����б��ת��Ϊ������������仯������ͼ��ʾ |
| C��S(g)+O2(g)��SO2(g)+Q3 Q3>296.83kJ |
| D����Ӧ��������1 L SO2 (g)�ų�297.16kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���й��ڸ�ͼ�������У���ȷ����
A��ͼ�ױ�ʾ��mol H2 (g)��ȫȼ������ˮ��������241.8 kJ����
B��ͼ�ױ�ʾ2 mol H2(g)�����е�������2 molH2O(g)�����е�������483.6 kJ
C��ͼ�ұ�ʾ������ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����ͬ�¡�ͬŨ�ȵ�NaA��Һ��pHС��NaB��Һ��pH
D��ͼ������ʼʱHA�����ʵ���Ũ�ȴ���HB
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�Լ״�Ϊ���ȼ���ǽ���ҹ�ʯ����Դ��ȱ����Ҫ��ʩ��
��1��CO��CO2�����ڼ״��ĺϳɣ�����ط�Ӧ���Ȼ�ѧ����ʽ���£�
CO(g)+2H2(g)=CH3OH(g) ��H=" -102.5" kJ��mol��1
CO(g)+H2O(g) = CO2(g)+H2(g) ��H="-42.9" kJ��mol��1
��ӦCO2(g)+3H2(g)=CH3OH(g)+H2O(g) ��H= kJ��mol��1
��ӦCO(g)+H2O(g) = CO2(g)+H2(g)��ƽ�ⳣ��K�ı���ʽΪ ��
��2����CO2�ϳɼ״�ʱ��ѡ���Ǹ���п��ZnCr2O4����CuClΪ������
�ٹ�ҵ�Ʊ��Ǹ���п����CO��ԭZnCrO4��H2O��ͬʱ����ZnO���÷�Ӧ�Ļ�ѧ����ʽ�� �����Ǹ���пΪ����ʱ����ҵ�ϵ������¶��ǣ�350��~420�棬���ܵ�ԭ���� ��
�� CuCl�Dz�����ˮ�İ�ɫ���壬�Ʊ�ʱ��CuCl2��Һ�м������ͭ�ۣ�������ӦCuCl2+Cu=2CuC1����ʵ�������Ӧ�ȼ���Ũ���ᣬ������ӦCuCl + HCl H[CuCl2]����Ӧ��������Һ��������ˮ����CuCl���ɡ�ʵ������м���Ũ�����Ŀ���� ����c(Cl-)=2��10-3 mol��L��1ʱ, c(Cu+-)= mol��L��1����֪��Ksp(CuCl)=1.7��10-7
H[CuCl2]����Ӧ��������Һ��������ˮ����CuCl���ɡ�ʵ������м���Ũ�����Ŀ���� ����c(Cl-)=2��10-3 mol��L��1ʱ, c(Cu+-)= mol��L��1����֪��Ksp(CuCl)=1.7��10-7
��3��ֱ�Ӽ״�ȼ�ϵ�ؽṹ��ͼ��ʾ������Ӧ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���ڻ�ѧ�������ܵ���������ȷ���ǣ� ��
| A��1mol�����ǡ���к�ʱ���ų����������к��� |
| B����ѧ��Ӧ�е������仯����Ҫ���ɻ�ѧ���ı仯����� |
| C��ȼ�ϵ�ط�Ӧʱ����ѧ�ܽ��� |
| D����Ӧ��������������������������ķ�Ӧ������Ҫ���ȾͿ����з�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
ij��ѧ��Ӧ�������仯��ͼ��ʾ�������й�������ȷ���ǣ� ��
| A���÷�Ӧ�ķ�Ӧ�ȡ�H=E2-E1 |
| B��a��b�ֱ��Ӧ�д����������������仯 |
| C�������ܽ��ͷ�Ӧ�Ļ�� |
| D�������ܸı䷴Ӧ���ʱ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���ʹ�����CO2�ĺ�������������Чʮ����Ҫ��
��1����ҵ����һ�ַ�������CO2�������״���
CO2(g)+3H2(g)  CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
��ͼ��ʾ�÷�Ӧ���й�������������λΪkJ��mol-1���ı仯���÷�Ӧ�� ������ȡ����ȡ�����Ӧ��
��2��ij�¶��£�����6mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼʵ����ʾ������������������ ���a��b����
0��8min�ڸ÷�Ӧ��ƽ������v(CO2)= mol/��L��min����
��3����CO��O2�ķ�Ӧ�У��ƻ�1molCO�еĻ�ѧ�����ĵ�����Ϊa kJ���ƻ�1molO=O�����ĵ�����ΪbkJ���γ�1molC=O���ͷŵ�����ΪckJ����1molCO�ڿ�������ȫȼ������CO2�ų�������Ϊ
kJ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������ͼ����д���Ȼ�ѧ����ʽAs2O5��s�� = As2O3�� s�� +O2�� g�� ��H =" a" kJ/mol����aΪ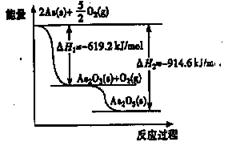
| A��+1533��8 | B���� 1533��8 | C��+295��4 | D����295��4 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com