
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
分析 A.若不改变温度,减小压强,平衡逆向移动,反应速率减小;
B.反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;
C.随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,A、B两点B点温度高;
D.乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值.
解答 解:A.若不改变温度,减小压强,平衡逆向移动,乙苯的转化率和反应速率都减小,故A正确;
B.由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1,故B错误;
C.图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,A、B两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,故C正确;
D.乙苯量越多,投料比越小,乙苯转化率越小,恒压条件下,水蒸气含量越高,分压越小,平衡朝体积增大方向移动,据此分析判断M的值,M1>M2>M3,故D错误;
故选AC.
点评 本题考查了化学平衡的计算、图象分析应用,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| C. | 25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、天然气、硫酸、醋酸、干冰 | |
| B. | 冰水混合物、胆矾、氯化钾、碳酸、乙醇 | |
| C. | 四氯化碳、硝酸、硫酸钡、二氧化碳、氧气 | |
| D. | 白酒、空气、苛性钠、硫酸、三氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
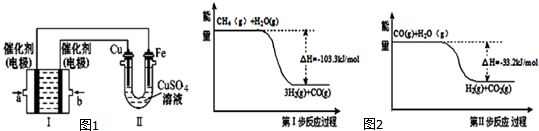
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(X)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(Y)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前10 min的平均速率为v(Z)=0.01mol•L-1•min-1 | |
| B. | 保持其他条件不变,降低温度,平衡时,c(X)=0.08mol•L-1,则a>0 | |
| C. | 恒压,其他条件不变,向容器中充入不参与反应的氮气作为稀释剂,X的转化率大于50.0% | |
| D. | 保持其它条件不变,再向容器中充入0.10 mol Y和0.10 mol Z,达到平衡后,该反应的平衡常数为0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com