
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
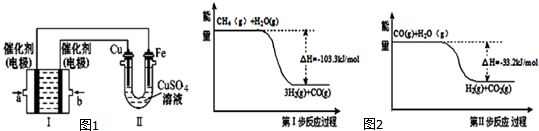
分析 (1)根据CH4的转化率=$\frac{转化量}{起始量}$×100%进行计算;根据温度对反应速率的影响判断;
(2)根据表格数据130℃和180℃平衡时CH4的量进行分析;
(3)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;甲烷失电子和氢氧根离子反应生成碳酸根离子和水;②根据I中氢氧根离子浓度变化确定溶液pH变化;③根据转移电子相等计算消失甲烷的体积;
(4)据图写出热化学方程式,再根据盖斯定律来计算反应的焓变,根据热化学方程式的书写规律来书写热化学方程式.
解答 解:(1)根据图表数据可知,130℃时,达到平衡状态时CH4的物质的量为0.10mol,故转化率=$\frac{转化量}{起始量}$×100%=$\frac{0.50-0.10}{0.50}$×100%=80%,
对比实验1知,40时该反应已经达到平衡状态,温度越高,反应速率越大,反应到达平衡的时间越短,所以40时实验2已经达到平衡状态,
故答案为:80%;是;温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态;
(2)根据表格数据及(1)中的答案发现,平衡时130℃比180℃甲烷的转化率高,说明温度越低,平衡越像正反应方向移动,所以正反应为放热反应;
温度越低,平衡越像正反应方向移动,说明温度低时平衡常数大;
故答案:<;>;
(3)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小,故答案为:减小;
③串联电路中转移电子相等,所以消耗甲烷的体积=$\frac{\frac{12.8g}{64g/mol}×2}{8}$×22.4L/mol=1.12L,故答案:1.12;
(4)根据第一步反应过程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g)△H=-103.3KJ/mol;
根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g)△H=-33.2KJ/mol;
根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol.
点评 本题考查较为综合,涉及化学平衡的判断、外界条件对反应速率及化学平衡的影响、盖斯定律以及原电池和电解池原理,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写.


科目:高中化学 来源: 题型:解答题
 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅在高温下 | B. | 在任何温度下都不能自发进行 | ||
| C. | 在任何温度下 | D. | 仅在低温下 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )
CH=CH2(g)+H2(g)工业上通常在乙苯蒸气中掺混水蒸气来保持体系总压为常压的条件下进行反应,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用下图表示:已知M=$\frac{m({H}_{2}O)}{n(乙苯)}$,下列说法正确的是( )| A. | 若不改变温度,减小压强使乙苯转化率和反应速率都减小 | |||||||||||
| B. | 已知
| |||||||||||
| C. | A、B两点对应的平衡常数大小:KA<KB | |||||||||||
| D. | 投料比的大小顺序:M1<M2<M3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要意义.
研究CO2的利用对促进低碳社会的构建具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224mL | D. | 672mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com