
| A、原电池跟电解池连接后,电子从电池负极流向电解池阳极 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分 |
| D、工业上铜的电解精炼时电解池中每转移1mol电子时阴极析出的铜小于0.5NA |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、2、2 | B、2、4 |
| C、4、2 | D、4、5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
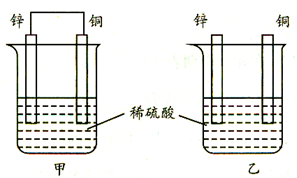 将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )| A、两烧杯中铜片表面均无气泡产生 |
| B、甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极,电极反应:Zn-2e→Zn2+ |
| C、两烧杯中的pH值均增大 |
| D、产生的气泡速率甲比乙慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
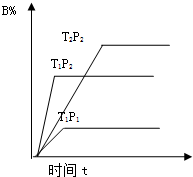 已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分
已知某可逆反应:mA(g)+nB(g)═pC(g)在密闭容器中进行,如图表示反应在不同时间t、温度T和压强P与反应物B在混合气体的体积分| A、T1<T2 P1>P2m+n>p 正反应为吸热反应 |
| B、T1>T2 P2>P1 m+n<p 正反应为吸热反应 |
| C、T2>T1 P2>P1m+n<p 正反应为吸热反应 |
| D、T1>T2 P2>P1 m+n<p 正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
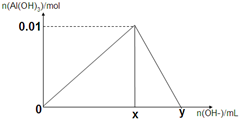 将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中.如图是整个过程的数学分析曲线.其中横轴表示加入OH-的体积,纵轴表示产生的Al(OH)3沉淀物质的量.据图示回答下列问题:
将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中.如图是整个过程的数学分析曲线.其中横轴表示加入OH-的体积,纵轴表示产生的Al(OH)3沉淀物质的量.据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉在空气中不稳定,可用于漂白纸张 |
| B、医用酒精能使蛋白质变性,可用于消毒杀菌 |
| C、二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| D、铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com