
【题目】一定温度下,在三个体积均为 2.0L 的恒容密闭容器中发生如下反应:A(g)![]() B(g)+C(g)
B(g)+C(g) ![]() H>0。
H>0。
起始物质的量(mol) | 平衡物质的量(mol) | |||||
容器 | 温度(℃) | A(g) | B(g) | C(g) | 达到平衡所需时间(s) | |
Ⅰ | T1 | 0.20 | 0.10 | 0.10 | t1 | |
Ⅱ | T2 | 0.40 | t2 | |||
Ⅲ | T3 | 0.20 | 0.15 | 0.15 | t3 | |
下列说法正确的是( )
A.达到平衡的时间:t3>t1
B.反应达到平衡时,A 的转化率:容器Ⅱ>容器
C.反应达到平衡时,容器 I 中的平均速率为 v(A)=(0.10/t1)mol/(L·s)
D.T1 时,该反应的平衡常数为 0.05
【答案】D
【解析】
A.I与III相比,起始量相同,III中反应正向进行程度大,可知T3>T1,升高温度反应速率加快,则达到平衡的时间:t3<t1,故A错误;
B.I与II的温度不同、起始量不同,温度、压强均影响平衡移动,且温度未知,不能比较A的转化率,故B错误;
C.反应达到平衡时,容器I中的平均速率为v(A)=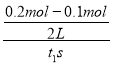 =
=![]() mol/(L·s),故C错误;
mol/(L·s),故C错误;
D.T1时,结合表中数据可知,
A(g)![]() B(g)+C(g)
B(g)+C(g)
开始/mol 0.2 0 0
转化/mol 0.1 0.1 0.1
平衡/mol 0.1 0.1 0.1
浓度/mol/L 0.05 0.05 0.05
T1时,该反应的平衡常数为K=![]() mol·L-1=0.05mol·L-1,故D正确;
mol·L-1=0.05mol·L-1,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)C是______溶液,D是______溶液。
(2)100mL0.01molL﹣1的B溶液与10mL 0.1molL﹣1的B溶液相比较,下列数值中,前者大于后者的是______ (填写序号)
①![]() ②
②![]() ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,相同pH的两种一元酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )

A. HA一定是强酸
B. a点溶液的导电性大于b点溶液
C. a点的c(HA)大于b点的c(HB)
D. HA的酸性强于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是__________________________(用化学方程式表示),所以他认为应该检验__________(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。

(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)_______。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸; ④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用____________________________________。
(4)C装置中出现的现象是_______________________________________________,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
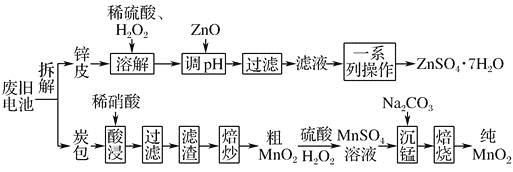
【题目】我国电池的年市场消费量约为80亿只,其中![]() 是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体
是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体![]() 和纯
和纯![]() 的工艺如下图所示:
的工艺如下图所示:
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为![]() 、
、![]() 、
、![]() 、碳粉等,还含有少量的Cu、Ag、Fe等。
、碳粉等,还含有少量的Cu、Ag、Fe等。
②![]() ;
;![]() ;
;![]() 。
。
(1)除去炭包中碳粉的操作为________。
A.酸浸 ![]() 过滤
过滤 ![]() 焙炒
焙炒 ![]() 焙烧
焙烧
(2)粗![]() 转化为
转化为![]() 时,主要反应的离子方程式为____________________________。
时,主要反应的离子方程式为____________________________。
(3)焙烧时发生反应的化学方程式为__________________________________________。
(4)制备硫酸锌晶体流程中,在溶解时加![]() 的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体
的作用是____________________________,用ZnO调节溶液pH的目的是_____________________________。滤液制备硫酸锌晶体![]() 的一系列操作为:____________、____________、________、洗涤、干燥。
的一系列操作为:____________、____________、________、洗涤、干燥。
(5)“草酸钠![]() 高锰酸钾返滴法”可测定
高锰酸钾返滴法”可测定![]() 的纯度,取
的纯度,取![]() 样品于锥形瓶中,加入适量稀硫酸,再加入足量的
样品于锥形瓶中,加入适量稀硫酸,再加入足量的![]() 溶液,最后用
溶液,最后用![]() 溶液滴定剩余的
溶液滴定剩余的![]() 。其中
。其中![]() 与
与![]() 溶液反应的离子方程式为__________________________________________。
溶液反应的离子方程式为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式(△H的绝对值均正确)书写正确的是 ( )
A.2CO(g)+O2(g)===2CO2(g); ![]() H=-566 kJ·mol-1(燃烧热)
H=-566 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l); ![]() H=+57.3 kJ·mol-1 (中和热)
H=+57.3 kJ·mol-1 (中和热)
C.C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l);![]() H=-1366.8 kJ·mol-1 (燃烧热)
H=-1366.8 kJ·mol-1 (燃烧热)
D.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l);![]() H=-114.6 kJ·mol-1 (中和热)
H=-114.6 kJ·mol-1 (中和热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学的应用十分广泛,在分析检测、有机合成等领域应用很广,请分析下列几种电化学装置并回答问题:

(1)肼(N2H4)又称联氨,可作燃料电池的燃料。肼燃料电池的原理如图 1 所示,正极上发生反应的电极反应式为___________________________________________;在肼燃料电池使用过程中,负极区的pH_____________(填写“增大”、“减小”或“不变”)。

(2)某模拟“人工树叶”的电化学实验装置如图2所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。该装置工作时,H+从____________(填字母,后同)极区向____________极区迁移,将电能转化为___________能,每生成3molO2,有______________gCO2被还原。
(3)图3中甲装置为C3H8O的燃料电池(电解质溶液为KOH溶液)装置,该同学想在乙装置中实现铁上镀铜,则f处通________________________________,写出电极c上的电极反应式:__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第____周期.第___族;PbO2的酸性比CO2的酸性_____(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_________________________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为________________,阴极上观察到的现象是_______________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________,这样做的主要缺点是__________________。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com