
【题目】下列热化学方程式(△H的绝对值均正确)书写正确的是 ( )
A.2CO(g)+O2(g)===2CO2(g); ![]() H=-566 kJ·mol-1(燃烧热)
H=-566 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l); ![]() H=+57.3 kJ·mol-1 (中和热)
H=+57.3 kJ·mol-1 (中和热)
C.C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l);![]() H=-1366.8 kJ·mol-1 (燃烧热)
H=-1366.8 kJ·mol-1 (燃烧热)
D.Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l);![]() H=-114.6 kJ·mol-1 (中和热)
H=-114.6 kJ·mol-1 (中和热)
【答案】C
【解析】
A. 2CO(g)+O2(g)===2CO2(g); ![]() H=-566 kJ·mol-1,可燃物CO的计量数不是1,燃烧热应是 CO(g)+0.5O2(g)===CO2(g);
H=-566 kJ·mol-1,可燃物CO的计量数不是1,燃烧热应是 CO(g)+0.5O2(g)===CO2(g); ![]() H=-283 kJ·mol-1,故A错误;
H=-283 kJ·mol-1,故A错误;
B. NaOH(aq)+HCl(aq) ===NaCl(aq)+H2O(l); 是放热反应,![]() H=-57.3 kJ·mol-1 ,故B错误;
H=-57.3 kJ·mol-1 ,故B错误;
C.在25℃,100kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热,单位为kJ·mol-1, C2H5OH(l)+3O2(g) ===2CO2(g)+3H2O(l);![]() H=-1366.8 kJ·mol-1,符合燃烧热的定义,故C正确;
H=-1366.8 kJ·mol-1,符合燃烧热的定义,故C正确;
D. Ba(OH)2(aq)+2HCl(aq)===BaCl2(aq)+2H2O(l);![]() H=-114.6 kJ·mol-1,生成的水不是1mol,表示中和热应为:0.5Ba(OH)2(aq)+HCl(aq)===0.5BaCl2(aq)+H2O(l);
H=-114.6 kJ·mol-1,生成的水不是1mol,表示中和热应为:0.5Ba(OH)2(aq)+HCl(aq)===0.5BaCl2(aq)+H2O(l);![]() H=-57.3 kJ·mol-1,故D错误;
H=-57.3 kJ·mol-1,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.

1)写出该反应的方程式:__________________
2)计算该温度下该反应的平衡常数:____________
3)已知:K(300℃)<K(350℃),该反应是__________热反应.
4)0~4分钟时,B的平均反应速率为:____________
5)到达平衡时A的转化率为:____________
6)恒容条件下,下列措施中能使n(A)/n(C)降低的有____________.
A.充入氦气 B.使用催化剂
C.再充入2.4molA和1.6molB D.降低温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3可被过量KIO3氧化,当NaHSO3完全消耗时即有I2析出。某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素。
(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:____________。
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
① | 10 | 15 | a | 10 | t1 |
② | 10 | 40 | 0 | 10 | t2 |
③ | 10 | b | 0 | 20 | t3 |
表中a=________,b=________。
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(“×××”表示超过50℃后溶液不会再变蓝)。
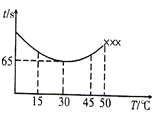
①在30℃下,若溶液变蓝时,I2的物质的量为n mol,则从反应开始至溶液变蓝,IO3-的平均反应速率______mol·L-1·s-1(写出表达式即可,不要化简)。
②根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:____。
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二:
假设一:反应生成的I2对反应起催化作用;
假设二:_________________________________________;
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定):____。
实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,CuS、MnS 在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 ( )
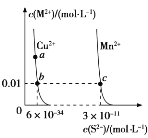
A.该温度下,Ksp(CuS)小于 Ksp(MnS)
B.a 点对应的 Ksp 等于 b 点对应的 Ksp
C.在含有 CuS 和 MnS 固体的溶液中 c(Mn2+)∶c(Cu2+)=2×10-23∶1
D.向 CuSO4 溶液中加入 MnS 发生如下反应:Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 2.0L 的恒容密闭容器中发生如下反应:A(g)![]() B(g)+C(g)
B(g)+C(g) ![]() H>0。
H>0。
起始物质的量(mol) | 平衡物质的量(mol) | |||||
容器 | 温度(℃) | A(g) | B(g) | C(g) | 达到平衡所需时间(s) | |
Ⅰ | T1 | 0.20 | 0.10 | 0.10 | t1 | |
Ⅱ | T2 | 0.40 | t2 | |||
Ⅲ | T3 | 0.20 | 0.15 | 0.15 | t3 | |
下列说法正确的是( )
A.达到平衡的时间:t3>t1
B.反应达到平衡时,A 的转化率:容器Ⅱ>容器
C.反应达到平衡时,容器 I 中的平均速率为 v(A)=(0.10/t1)mol/(L·s)
D.T1 时,该反应的平衡常数为 0.05
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)=Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) ΔH=____________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法:反应原理:恒温恒容时2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度如图:
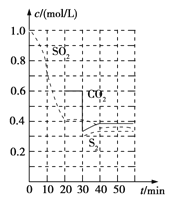
①0~20 min反应速率表示为v(SO2)=____________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是____________;
③平衡常数的表达式K=____________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是____________(填序号)。
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
d.水电离出c(H+)=1×10-8mol/L
(3)电化学处理法

①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。实验时按如下步骤操作:

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数。
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_______________________;装置②的作用是_________________________
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为_______________________________________________________。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是____________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是___________(写一种即可)。
(5)某人设想以右图所示装置用电化学原理生产硫酸, 写出通入SO2的电极的电极反应式___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]()
![]()
![]() 在密闭容器反应,达到平衡状态的标志是( )
在密闭容器反应,达到平衡状态的标志是( )
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A.(1)(2)(3)(4)(5)B.(2)(3)(4)C.(1)(3)(4)(5)D.(1)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物![]() 的结构简式如图
的结构简式如图![]() 的说法正确的是
的说法正确的是
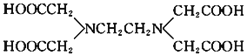
A.![]() 中所含的化学键有离子键、共价键、配位键和氢键
中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为![]() 、
、![]()
C.![]() 的组成元素的第一电离能顺序为
的组成元素的第一电离能顺序为![]()
D.![]() 与
与![]() 互为等电子体,但空间构型不同
互为等电子体,但空间构型不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com