
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可以是 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g) 方法二 CO2(g)+3H2(g)
CH3OH(g) 方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式 。
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H=―393.5kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H=―566kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+141kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―235.8kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ·mol―1
则O3转化为O2的热化学方程式为 。
【答案】(1)C+CuO![]() Cu+CO↑
Cu+CO↑
(2)等于 △H1=△H2+1/2(△H3+△H4)
(3)CH4O(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol
(4)-80kJ/mol(5)2O3(g)=3O2(g) △H=-285kJ/mol
【解析】
试题分析:(1)①是置换反应可以是碳和水蒸气反应生成一氧化碳和氢气,或与金属氧化物反应,反应的化学方程式为C+CuO![]() Cu+CO↑;
Cu+CO↑;
(2)由盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同;根据盖斯定律,①=②+③×1/2+④×1/2,所以△H1=△H2+1/2
(△H3+△H4);
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76kJ;则表示甲醇燃烧热的热化学方程式为CH4O(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.76kJ/mol;
(4)已知:①C(s)+O2(g)=CO2(g) △H=―393.5kJ·mol―1
②2CO(g)+O2(g)=2CO2(g) △H=―566kJ·mol―1
③TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+141kJ·mol―1
根据盖斯定律可知①×2-②+③得到TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H=-80 kJ/mol;
(5)Ⅰ、6Ag(s)+O3(g)=3Ag2O(s) △H=―235.8kJ·mol―1
Ⅱ、2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ·mol―1
根据盖斯定律可知Ⅰ×2+Ⅱ×3可得到,2O3(g)═3O2(g),则反应热△H=(-235.8kJmol-1)×2+(+62.2kJmol-1)×3=-285kJ/mol。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学用图Ⅰ所示的装置验证一些物质的性质。下列说法错误的是
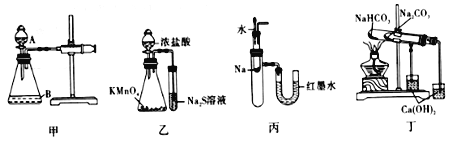
A.图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
B.图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱
C.将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升
D.图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、NO
、Cl-、NO![]() 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________;肯定不存在的离子是 。
(2)写出有关离子方程式:步骤①中生成A___________________;步骤②生成沉淀I______________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,对于pH=3的醋酸溶液。下列说法正确的是( )
A.在醋酸溶液中,NH4+、Na+、SiO32-、C2O42-能大量共存
B.与Na2S2O3溶液反应的离子方程式:S2O32-+2H+=S↓+SO2↑+H2O
C.常温下,加水稀释醋酸,![]() 增大
增大
D.该醋酸溶液中c(CH3COO-)<0.001mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度⑤混合气体的摩尔质量
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度⑤混合气体的摩尔质量
A.①④⑤ B.②③ C.②③④ D.只有④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
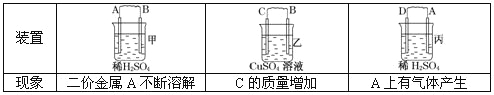
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是____________________.
(2)装置乙中正极的电极反应式是_________________________.
(3)四种金属活泼性由强到弱的顺序是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组借助A-D的仪器装置完成有关实验。
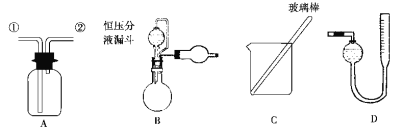
为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH===Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(1)选用B和_____________(填仪器标号)两个装置进行实验。
(2)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=_____________。
(3)计算镀层厚度,还需要检索的一个物理量是_____________。
(4)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将_____________(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(5)ω(Zn)=____________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(6)从实验误差角度分析,方案丙__________方案乙( “优于”、“劣于”或“等同于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com