
【题目】某同学用图Ⅰ所示的装置验证一些物质的性质。下列说法错误的是
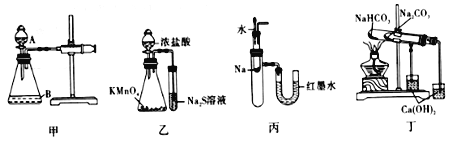
A.图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
B.图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱
C.将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升
D.图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】含铬(Cr)工业废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀。转化过程中,废水pH与Cr2O72-转化为Cr3+的关系如图1所示,实验室模拟工业电解法处理含铬废水的装置如图2所示。


请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是______________。
(2)写出下列反应的离子方程式:
①电解过程中的阴极反应式_________________;
②Cr2O72-转化为Cr3+的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
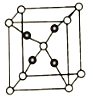
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1).制取MgCl2的过程中涉及反应:MgCl2.6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
(2).在实验室模拟氯碱工业电解饱和食盐水,用玻璃棒蘸浓氨水检验阳极产生的气体,生成大量白烟。写出化学方程式____________________。直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,写出相应的化学方程式:___________________,下列措施能增强“84”消毒液杀菌能力的是___________(填序号)
A.加入适量醋酸b.加入适量亚硫酸
c.加入少量NaOH粉末D.加入适量的稀盐酸
(3).生活中常用ClO2净化自来水,将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂和还原剂的物质的量之比为__________。有效氯含量可以来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________(结果保留小数点后1位)。
(4).某学习小组探究过氧化钠和二氧化硫的化学反应,有同学认为类似于过氧化钠和二氧化碳的反应,有同学认为二氧化硫全被氧化,现向过氧化钠中通入足量的二氧化硫,请设计实验证明二氧化硫部分被氧化:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,甲容器中充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是( )
A.若两种气体体积相等,甲、乙两容器中气体的密度之比为35∶37
B.若两种气体体积相等,甲、乙两容器中气体分子数之比为35∶37
C.若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37∶35
D.若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9∶10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是
A. 铁片与过量浓硝酸(常温) B. 铜粉与过量浓硝酸(常温)
C. 浓盐酸与过量MnO2(共热) D. 浓硫酸与过量铜片(共热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号中的试剂除去各组中的杂质,不正确的是( )
A. 苯中的甲苯(溴水) B. 乙醇中的水(新制CaO)
C. 乙醛中的乙酸(NaOH) D. 乙酸乙酯中的乙酸(饱和Na2CO3溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.焓变和熵变都大于0的反应肯定是自发的
B.焓变小于0而熵变大于0的反应肯定是自发的
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可以是 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g) 方法二 CO2(g)+3H2(g)
CH3OH(g) 方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克甲醇完全燃料放热22.68kJ,写出甲醇燃烧热的热化学方程式 。
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H=―393.5kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H=―566kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+141kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―235.8kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+62.2kJ·mol―1
则O3转化为O2的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com