
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
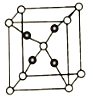
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3
【答案】(1)正四面体型;sp3(2)大于氨气分子间有氢键
(3)![]() PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4
PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4
(4)Cu2++4NH3=[Cu(NH3)4]2+降低溶质的溶解度(5)Cu2O![]()
【解析】
试题分析:A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同,因此A是H。B是同周期元素未成对电子数最多的元素,则B是N;C的最外层电子数为其电子层数的3倍,因此C是O;B与D同族,则D是P;
(1)P的一种单质,难溶于水,较易溶于苯且易自燃,因此是白磷,其立体结构为正四面体型;,D原子的杂化类型为sp3杂化。
(2)A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂,则M是氨气。A和D的单质反应得到化合物N,N还是PH3。由于氨气分子间有氢键,因此氨气的沸点大于PH3。
(3)已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸,红色固体是铜,两种酸是硫酸和磷酸,反应的化学反应方程式为PH3+4CuSO4+4H2O=4Cu+H3PO4+4H2SO4。铜是29号元素,铜的价层电子为3d、4s电子,其价层电子排布图为![]() 。
。
(4)铜离子能与氨气形成配位键,反应的离子反应方程式为Cu2++4NH3=[Cu(NH3)4]2+,加入乙醇的作用是降低溶质的溶解度。
(5)该晶胞中氧原子个数=1+8×1/8=2,铜原子个数为4,该晶胞中氧原子和铜原子个数之比=2:4=1:2,所以化合物的化学式为Cu2O;若两个氧原子间最短距离为apm,设晶胞的边长为x,则![]() ,解得x=
,解得x=![]() ,则
,则 。
。


科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种微粒。其中
六种微粒。其中![]() 的物质的量随时间变化的曲线如图所示。下列判断中正确的是( )
的物质的量随时间变化的曲线如图所示。下列判断中正确的是( )
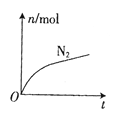
A.该反应的还原剂是![]()
B.消耗![]() 还原剂,转移
还原剂,转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡是无色液体,熔点-33℃,沸点114℃。氯气与金属锡在加热时反应可以用来制备SnCl4 , SnCl4 极易水解,在潮湿的空气中发烟。实验室可以通过下图装置制备少量SnCl4 (夹持装置略)。
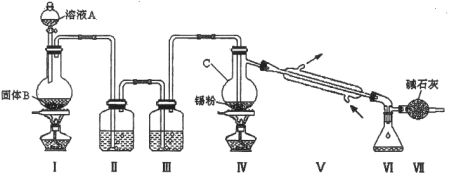
(1)仪器C的名称为: ;
(2)装置Ⅰ中发生反应的离子方程式为: ;
(3)装置Ⅱ中的最佳试剂为 ,装置Ⅶ的作用为 ;
(4)若装置连接顺序为Ⅰ—Ⅱ一Ⅳ一Ⅴ一Ⅵ一Ⅶ,在Ⅳ中除生成SnCl4 外,还会生成的含锡的化合物的化学式为 。
(5)Ⅳ中加热的作用之一是促进氯气与锡粉反应,加热的另一作用为 ;
(6)若Ⅳ中用去锡粉11.9 g,反应后,Ⅵ中锥形瓶里收集到23.8 g SnCl4 ,则SnCl4 的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素及其化合物的说法中正确的是( )
A.Fe为活泼金属,常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应
B.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成NaHCO3
C.铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 mol FeI2溶液中: 2Fe2++2I-+2Cl2==2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-==HClO+HSO | 正确;说明酸性: H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2AlO | 正确;AlO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
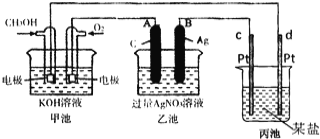
(1)请回答图中甲池是___________装置,其中OH-移向___________极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是___ .
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为___________极(填“A”或“B”),并写出此电极反应的电极反应式____ .
(4)乙池中反应的离子方程式为___ .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是___________(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是___________(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水常用Cl2消毒,某学生在实验室用这种自来水去配制下列物质的溶液,不会产生明显药品变质问题的是( )
① NaBr ② FeCl3 ③ Na2SO3 ④ AlCl3 ⑤ FeSO4 ⑥ NaHCO3
A.①③ B.②④ C.③④⑥ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用图Ⅰ所示的装置验证一些物质的性质。下列说法错误的是
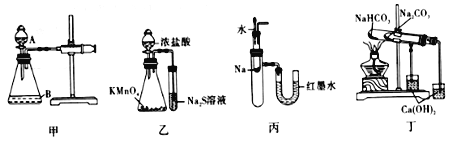
A.图甲中,为检查装置的气密性,可关闭分液漏斗A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否复原
B.图已中,可以比较KMnO4、Cl2和S氧化性的相对强弱
C.将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升
D.图丁中,可用装置验证NaHCO3和Na2CO3的热稳定性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、NO
、Cl-、NO![]() 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________;肯定不存在的离子是 。
(2)写出有关离子方程式:步骤①中生成A___________________;步骤②生成沉淀I______________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com