
【题目】如图是一个化学过程的示意图。
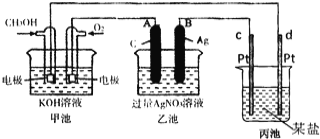
(1)请回答图中甲池是___________装置,其中OH-移向___________极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是___ .
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为___________极(填“A”或“B”),并写出此电极反应的电极反应式____ .
(4)乙池中反应的离子方程式为___ .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是___________(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是___________(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
【答案】
(1)原电池;负;
(2)CH3OH-6e-+8OH-=CO32-+6H2O;
(3)A;2H2O-4e-=4H++O2↑;
(4)2H2O+4Ag+![]() 4H++O2↑+4Ag;(5)1;BD;
4H++O2↑+4Ag;(5)1;BD;
【解析】
试题分析:(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,故答案为:原电池;负;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4H2O-4e-=O2↑+4H+,故答案为:A,4H2O-4e-=O2↑+4H+;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O=4Ag+O2↑+4H+,故答案为:4Ag++2H2O![]() 4Ag+O2↑+4H+;
4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加2.70g时,设氢离子浓度为xmol/L,
4Ag++2H2O=4Ag+O2↑+4H+;
432g 4mol
2.70g 0.25xmol
x=0.1,则溶液的pH=1,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素,析出2.70g时转移电子是0.025mol。A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;B、电解硫酸铜溶液时,阴极上析出0.80g铜需要转移电子0.025mol,故正确;C、氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;D、电解硝酸银溶液时,阴极上析出0.80g银需要转移电子0.0074mol<0.025mol,故正确;故选BD;故答案为:1;BD。


科目:高中化学 来源: 题型:
【题目】除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物 | 试剂 | 分离方法 | |
A | 苯(苯酚) | 碱液 | 过滤 |
B | 乙烷(乙烯) | 氢气 | 加热 |
C | 乙醇(水) | 生石灰 | 蒸馏 |
D | 苯(甲苯) | 蒸馏水 | 分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A.0.2mol·L-1 Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B.50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C.用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D.10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不能用H++OH-=H2O表示的是( )
A. 硫酸氢钠和氢氧化钡 B. 氢氧化钾和盐酸
C. 硝酸和氢氧化钠 D. 氢氧化钡和硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
A、B、C、D、E为原子序数依次增大的前四周期的元素,A的核外电子总数与其周期数相同。B是同周期元素未成对电子数最多的元素,C的最外层电子数为其电子层数的3倍,B与D同族;回答下列问题:
(1).D的一种单质,难溶于水,较易溶于苯且易自燃,其立体结构为_______________,D原子的杂化类型为_______________。
(2).A和B的单质反应可生成化合物M,常温下M为气态,易液化可作制冷剂。A和D的单质反应得到化合物N,M的沸点________(填“大于”、“小于”、或“等于”)N的沸点,原因是_______________。
(3).已知N可以与E的一种盐溶液反应,生成红色固体单质和两种高沸点酸。E原子的外围电子排布图为____________________。写出相应的化学反应方程式:____________________。
(4).将M通入E的硫酸盐溶液中,可得到深蓝色透明溶液,再向溶液中加入一定量的乙醇,有深蓝色晶体析出。写出离子反应方程式:__________________,加入乙醇的作用是________________。
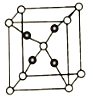
(5).E和C能形成化合物G,其晶体结构如图25所示,G的化学式为__________。若两个氧原子间最短距离为apm,列式计算晶体G的密度_______g.cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
(1).制取MgCl2的过程中涉及反应:MgCl2.6H2O![]() MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是____________________。
(2).在实验室模拟氯碱工业电解饱和食盐水,用玻璃棒蘸浓氨水检验阳极产生的气体,生成大量白烟。写出化学方程式____________________。直接电解氯化钠稀溶液可制备“84”消毒液,所得消毒液仅含一种溶质,写出相应的化学方程式:___________________,下列措施能增强“84”消毒液杀菌能力的是___________(填序号)
A.加入适量醋酸b.加入适量亚硫酸
c.加入少量NaOH粉末D.加入适量的稀盐酸
(3).生活中常用ClO2净化自来水,将SO2通入硫酸酸化的KClO3可以制备ClO2,氧化剂和还原剂的物质的量之比为__________。有效氯含量可以来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为__________(结果保留小数点后1位)。
(4).某学习小组探究过氧化钠和二氧化硫的化学反应,有同学认为类似于过氧化钠和二氧化碳的反应,有同学认为二氧化硫全被氧化,现向过氧化钠中通入足量的二氧化硫,请设计实验证明二氧化硫部分被氧化:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是
A. 铁片与过量浓硝酸(常温) B. 铜粉与过量浓硝酸(常温)
C. 浓盐酸与过量MnO2(共热) D. 浓硫酸与过量铜片(共热)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com