
【题目】将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是( )
A.c(H+) B.Ka(HF) C.![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
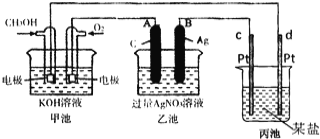
(1)请回答图中甲池是___________装置,其中OH-移向___________极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是___ .
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为___________极(填“A”或“B”),并写出此电极反应的电极反应式____ .
(4)乙池中反应的离子方程式为___ .
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是___________(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是___________(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA
B.46gNO2和N2O4混合气体中含有原子总数为3NA
C.标准状况下,22.4LSO3中含有的分子数为NA.
D.1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关颜色的变化不能用勒夏特列原理解释的是( )
A.平衡状态的H2、I2、HI混合气体体积压缩时颜色变深
B.平衡状态的NO2和N2O4混合气体体积压缩时颜色先变深后变浅
C.平衡状态的NO2、CO、NO、CO2混合气体升温时颜色变深
D.向Fe(SCN)3溶液中滴加几滴浓KSCN溶液后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH![]() 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、NO
、Cl-、NO![]() 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是________________;肯定不存在的离子是 。
(2)写出有关离子方程式:步骤①中生成A___________________;步骤②生成沉淀I______________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质及非电解质的组合完全正确的是( )
A | B | C | D | |
强电解质 | NaCl | H2SO4 | NaOH | HNO3 |
弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
非电解质 | Cl2 | CO2 | C2H5OH | SO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A. N是构成细胞内蛋白质、胃蛋白酶必不可少的元素,属于大量元素
B. Mg是叶绿素分子必不可少的组成元素,属于大量元素
C. Fe是血红蛋白分子必不可少的组成元素,属于大量元素
D. P是磷脂、DNA、RNA等有机物的组成元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com