
【题目】为了探究某固体化合物X(仅含3种元素,相对分子质量小于200)的组成和性质,设计并完成如下实验,其中X、A、B、C、D均为常见化合物。

请回答:
(1)黄色溶液中的金属阳离子是________。
(2)固体A→白色沉淀B的离子方程式是______________________________。
(3)X的化学式是_____________________________________。
【答案】Fe3+ SO3+Ba2++ H2O=BaSO4↓+2H+ FeSO4
【解析】
由黄色溶液中加入KSCN溶液,溶液变为血红色可知,黄色溶液为氯化铁溶液,则D为氧化铁;由气体C能使品红溶液褪色可知,C为二氧化硫,固体A与氯化钡溶液反应生成白色沉淀B,说明A为三氧化硫、B为硫酸钡;由质量守恒定律可知m(A)=30.4g-
(16.0g+0.1mol×64g/mol)=8.0g,则n(Fe2O3)= 0.1mol ,n(SO2)= 0.1mol ,n(SO3)=0.1mol,由铁原子、氧原子和硫原子个数守恒可知X中n(Fe):n(S):n(O)=0.2:0.2:(0.3+0.2+0.3)
=1:1:4,X为硫酸亚铁。
(1)黄色溶液为氯化铁溶液,溶液中的金属阳离子是Fe3+,故答案为:Fe3+;
(2)固体A→白色沉淀B的反应为三氧化硫与氯化钡溶液反应生成硫酸钡白色沉淀,反应的离子方程式是SO3+Ba2++ H2O=BaSO4↓+2H+,故答案为:SO3+Ba2++ H2O=BaSO4↓+2H+;
(3)由质量守恒定律可知m(A)=30.4g-(16.0g+0.1mol×64g/mol)=8.0g,则n(Fe2O3)= 0.1mol ,n(SO2)= 0.1mol ,n(SO3)=0.1mol,由铁原子、氧原子和硫原子个数守恒可知X中n(Fe):n(S):n(O)=0.2:0.2:(0.3+0.2+0.3)=1:1:4,X为硫酸亚铁,故答案为:FeSO4。


科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法不正确的是

A. b点对应的Ksp等于c点对应的Ksp
B. 采取蒸发溶剂的方法可以使溶液从a点变到b点
C. 该温度下,Ag2SO4的Ksp=1.6×10-5
D. 0.02 mol·L-1的AgNO3溶液与0.2 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马来酸酐(顺-丁烯二酸肝)![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。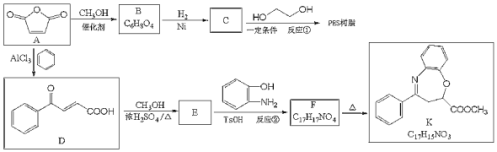
己知:
I.![]() +
+![]()
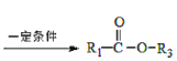 +
+![]()
II.![]()
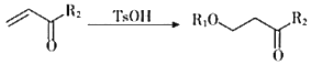
III.![]()
 +H2O(
+H2O(![]() 代表烃基)
代表烃基)
回答下列问题:
(1)C的名称是__________,反应②的反应类型是_______
(Q)B的顺式结构简式为_________,F含氧官能团的结构简式__________。
(3)反应①的化学方程式为_______________。
(4)C有多种同分异构体,其中与C具有完全相同的官能团,且核磁共振氢谱只有两个峰的同分异构体的结构简式为__________(不考虑立体异构)。
(5)己知:氨基(![]() )与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为
)与羟基类似,也能发生反应I。在由F制备K的过程中,常会产生副产物L,L分子式为![]() ,含三个六元环,则L的结构简式为________。
,含三个六元环,则L的结构简式为________。
(6)写出由B合成酒石酸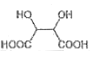 (的合成路线:_______________________。
(的合成路线:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应总伴随着能量的变化,下列叙述中正确的是
A.图1表示25min内,Y的平均速率为0.016molL-1min-1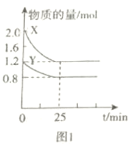
B.图2可表示碳与二氧化碳的反应能量变化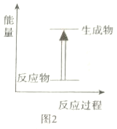
C.图3表示在铁金属内部电子流向碳一侧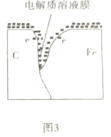
D.图4表示反应2NO+2CO=N2+2CO2中NO和CO转化率为2:1时,反应达平衡状态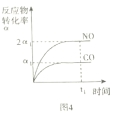
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
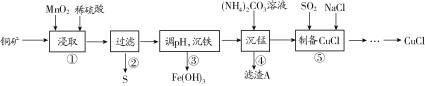
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 7.1 | 10.1 |
Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面列出了几组物质:A.金刚石与石墨;B.丙烯与环丙烷;C.氕与氘;D.甲烷与戊烷;E.液氨与氨水;F. ![]() 与
与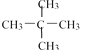 ;G.
;G. 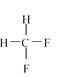 与
与 ,请将物质的合适组号填写在空格上。
,请将物质的合适组号填写在空格上。
①同位素_________
②同素异形体_________
③同系物_________
④同分异构体_________
⑤同一物质_________。
(2)下列物质中:①Ar ②MgBr2 ③Na2O2 ④H2SO4 ⑤CS2 ⑥NH4Br ⑦BaO ⑧RbOH。只存在共价键的是_________ (填序号,下同),只存在离子键的是_________,既存在离子键又存在极性共价键的是_________,既存在离子键又存在非极性共价键的是_________。
(3)异丁烷的一氯代物有_________种,新戊烷的一氯代物有_________种。C3H2Cl6的同分异构体有_________种,C5HCl11的同分异构体有_________种,乙烷和氯气在光照条件下发生取代反应所得产物最多有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com