
����Ŀ��0.3 molij��A����������ȫȼ�պ�����CO2��H2O��1.2 mol���Իش�
��1����A�ķ���ʽΪ_____________��
��2����ȡһ�����ĸ���A��ȫȼ�պ�����CO2��H2O��3mol������________g��A�μ��˷�Ӧ��ȼ��ʱ���ı�״���µ�����___________L��
��3������A��HCl��Ӧ�������ɲ����е�Hԭ�ӵĽṹ������ȫ��ͬ��д���÷�Ӧ�Ļ�ѧ����ʽ_____��
��4������A��Br2��CCl4��Һ��Ӧ��IJ���Ϊ1,2-���嶡�飬��д������A�����Ӿ۷�Ӧ�Ļ�ѧ����ʽ_________________________________________��
���𰸡� C4H8 42 100.8 ![]() + HCl��
+ HCl�� nCH2��CHCH2CH3
nCH2��CHCH2CH3![]()
![]()
����������1��0.3 molij��A����������ȫȼ�պ�����CO2��H2O��1.2 mol����1mol��������������ȫȼ�պ�����CO2��H2O��4 mol�����Է���ʽΪC4H8��
��2��ȡһ�����ĸ���A��C4H8����ȫȼ�պ�����CO2��H2O��3mol��������AΪ0.75mol������Ϊ0.75��56=42g����ӦΪC4H8 + 6O2 = 4CO2 + 4H2O������0.75mol C4H8��Ҫ������Ϊ0.75��6��22.4=100.8L��
��3����A��HCl��Ӧ���÷�Ӧֻ���Ǽӳɣ�˵��AΪ��ϩ���ӳɺ�һ���õ�һ�ȴ����飬Hԭ�ӵĽṹ������ȫ��ͬ�����һ�ȴ�����ֻ���� ������AΪ
������AΪ![]() ����ӦΪ
����ӦΪ![]() + HCl��
+ HCl�� ��
��
��4����A��Br2��CCl4��Һ��Ӧ��IJ���Ϊ1,2-���嶡�飬��AΪ1-��ϩ��A�����Ӿ۷�Ӧ�Ļ�ѧ����ʽΪnCH2��CHCH2CH3![]()
![]()


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2SO3��I2��H2O == H2SO4��2HI����0.1mol Cl2ͨ��100mL�������ʵ�����HI��H2SO3�Ļ����Һ������һ���HI��������������˵����ȷ����
A. ���ʵĻ�ԭ����HI��H2SO3��HCl
B. H2SO3�����ʵ���Ũ��Ϊ0.6 mol��L��1
C. ����ͨ��0.05mol Cl2��ǡ���ܽ�HI��H2SO3��ȫ����
D. ͨ��0.1mol Cl2������Ӧ�����ӷ���ʽΪ��5Cl2��4H2SO3��2I����4H2O == 4SO42����I2��10Cl����16H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������У�SO2�ڽӴ����б�������ΪSO3���壬��֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2 mol SO2��1 mol O2����һ�ܱ�������ַ�Ӧ�ų�����98��3 kJ����ʱ���SO2��ת����Ϊ50%���������Ȼ�ѧ����ʽ��ȷ����
A. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����196��6 kJ��mol��1
2SO3(g) ��H����196��6 kJ��mol��1
B. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����98��3 kJ��mol��1
2SO3(g) ��H����98��3 kJ��mol��1
C. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����98��3 kJ��mol��1
SO3(g) ��H����98��3 kJ��mol��1
D. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����196��6 kJ��mol��1
SO3(g) ��H����196��6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͼ���ʾ����ϸ����Ԫ�ء������P�����ã�a��b��c��d��e������ͬ��С�������ʣ�A��B��C��E������ͬ�Ĵ�������ʣ����з�������ȷ���ǣ� ��
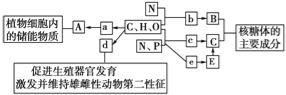
A. �ڶ���ϸ������A�������������������ԭ
B. ����d�Ļ�ѧ�����ǹ̴�
C. e��c�������ǿռ�ṹ��ͬ
D. ������ϸ��������e����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���ճ�����������أ������й�˵���������
A. Fe3O4��������ɫ�����Ϳ�� B. ��84����Һ������Ч�ɷ���NaClO
C. SO2����ֽ������ñ���Ư�� D. ��ԭ���ۿ���ʳƷ��װ���ڵĿ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����(����)
A. ����ˮ��Ӧ��Na��H2O===Na����OH����H2��
B. ϡ����������������Һ��Ӧ��H����OH��===H2O
C. �����Ȼ�����Һ��Ӧ��Fe��Fe3��===2Fe2��
D. ��������������Һ��Ӧ��2Al��2OH����2H2O===2A1O![]() ��3H2��
��3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������У��ȿ����ɽ���������������Ӧ�Ƶã�����ͨ���������������ᷴӦ�Ƶõ���
A. CuCl2 B. MgCl2 C. FeCl3 D. FeCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ����ϸ����Ԫ�ؼ������a��b��c��d������ͬ��С�������ʣ�A��B��C������ͬ�Ĵ�������ʣ�������ش��������⡣
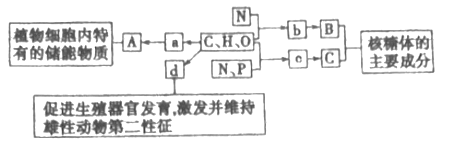
��1������a��__________���ڶ���ϸ���ڣ�������A�����������������____________��
��2������d��_________��d��_____________��ά����D�����ڹ̴������ʡ�
��3������c������ϸ���й���______�֣�����֮����ͨ��___________����ѧ�������������ģ��γ�һ��C����C����ˮ����ܵ�__________�ֻ����
��4������ϸ���к���ķֲ���ʹ�õ��Լ���___________________����ʵ���������ᴦ��ϸ���������������______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1����֪16��A��20��Bǡ����ȫ��Ӧ����0.05mol C��30��D����C��Ħ������Ϊ
��2��0.3mol������0.4mol������̼�����������ȡ�����ȡ�����ͬ��������ԭ���� ��
��3��4g H2��22.4L����״����CO2��ȣ�����������Ŀ�϶���� ��
��4��3.01��1023��CO2�����к�mol��ԭ�ӣ��ڱ�״���������ΪL������g H2O������ͬ����ԭ������
��5��д���������ʵĵ��뷽��ʽ����������������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com