
【题目】已知H2SO3+I2+H2O == H2SO4+2HI,将0.1mol Cl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是
A. 物质的还原性:HI>H2SO3>HCl
B. H2SO3的物质的量浓度为0.6 mol·L-1
C. 若再通入0.05mol Cl2,恰好能将HI和H2SO3完全氧化
D. 通入0.1mol Cl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O == 4SO42-+I2+10Cl-+16H+
【答案】D
【解析】根据H2SO3+I2+H2O == H2SO4+2HI可知,H2SO3还原性大于HI;将0.1mol Cl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,氯气先氧化H2SO3,再氧化HI;物质的还原性:H2SO3>HI>HCl,故A错误;设H2SO3的物质的量为xmol,则H2SO3消耗氯气为xmol;有![]() 的HI被氧化,消耗氯气
的HI被氧化,消耗氯气![]() ,xmol+
,xmol+ ![]() =0.1mol,x=0.08mol,所以H2SO3的物质的量浓度为0.8 mol·L-1,故B错误;0.08molH2SO3消耗氯气为0.08mol,0.08molHI消耗氯气为0.04mol,共消耗氯气0.12mol,所以若再通入0.02mol Cl2,恰好能将HI和H2SO3完全氧化,故C错误;通入0.1mol Cl2被氧化的HI只有H2SO3的一半,发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O == 4SO42-+I2+10Cl-+16H+,故D正确。
=0.1mol,x=0.08mol,所以H2SO3的物质的量浓度为0.8 mol·L-1,故B错误;0.08molH2SO3消耗氯气为0.08mol,0.08molHI消耗氯气为0.04mol,共消耗氯气0.12mol,所以若再通入0.02mol Cl2,恰好能将HI和H2SO3完全氧化,故C错误;通入0.1mol Cl2被氧化的HI只有H2SO3的一半,发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O == 4SO42-+I2+10Cl-+16H+,故D正确。


科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等症状,以致死亡。该外毒素为环状肽,其结构简式如图所示:

请据图分析回答:
(1)该化合物中含有游离的___________个氨基,___________个羧基。
(2)该化合物是由___________个氨基酸组成的,区别这些氨基酸的种类依靠的是其结构中的___________。
(3)组成该化合物的氨基酸有_________种,其中有_______个氨基酸的R基相同,这个R基是________。
(4)该化合物为___________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A.______________________, B.______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在下列物质转化中A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答:
(1)A的化学式是______, Z的电子式是______。
(2)当X是强酸时,写出C→D的化学方程式:_____。
(3)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____。
II、在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (其相对分子质量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(4)为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____(填字母代号)。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(5)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
①上表中第一次实验中记录数据明显大于后两次,其原因可能是_____(填字母代号)。
A.滴定前滴定管尖嘴无气泡,滴定结束有气泡
B.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
D.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
②通过实验数据计算的该产品纯度为_____(用字母a、c表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的性质说法正确的是
A.棉花和蛋白质都是高分子化合物,水解产物相同
B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应
C.乙酸乙酯和油脂互为同系物
D.甲烷和乙醇均能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:① 2Fe3++H2O2 == 2Fe2++O2↑+2H+,② H2O2+2Fe2++2H+ == 2H2O+2Fe3+。反应过程中能量变化如下图所示。下列说法错误的是
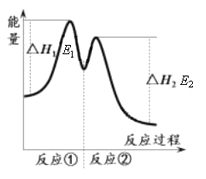
A. Fe3+的作用是增大过氧化氢的分解速率
B. 反应①是吸热反应、反应②是放热反应
C. 反应2H2O2(aq) == 2H2O(l)+O2(g)的ΔH=E1-E2<0
D. 0~6 min的平均反应速率:v(H2O2)=3.33×10-2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
B. 铅蓄电池在放电过程中,负极质量增加,正极质量减少
C. 100 mL pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气多,说明HA的酸性比HB的弱
D. 已知I3-![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.3 mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为_____________。
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则有________g烃A参加了反应,燃烧时消耗标准状况下的氧气___________L。
(3)若烃A跟HCl反应后,生成产物中的H原子的结构环境完全相同,写出该反应的化学方程式_____。
(4)若烃A与Br2的CCl4溶液反应后的产物为1,2-二溴丁烷,请写出由烃A发生加聚反应的化学方程式_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com