
����Ŀ�������й�˵����ȷ����
A. �ϳɰ���Ӧ��ʹ�ô�����˵���������Դٽ���ƽ�������ɰ��ķ����ƶ�
B. Ǧ�����ڷŵ�����У������������ӣ�������������
C. 100 mL pH��3��HA��Һ��HB��Һ�ֱ���������п��Ӧ��HA��Һ�ų��������࣬˵��HA�����Ա�HB����
D. ��֪I3-![]() I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
���𰸡�C
�����������������A��ʹ�ô��������ͻ�ܣ��ı䷴Ӧ;���ӿ췴Ӧ���ʣ���Ӱ��ƽ���ƶ�����A����B��Ǧ�����ڷŵ���̣�Ϊԭ��أ�Pb��������PbO2Ϊ������������Ӧ������PbSO4���������������ӣ���B����C�������pH=3��HA��Һ��HB��Һ�ֱ���������п��Ӧ��HA��Һ�ų��������࣬˵��HA�����ṩ�������Ӷ࣬HA�ĵ���̶ȱ�HBС��HA�����Ա�HB��������C��ȷ��D����ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��CCl4��ȡ��Һ�е�I2��˵��I2��CCl4�е��ܽ�ȱ���ˮ�еĴ�D����ѡC��


 �����ҵ���������ϵ�д�
�����ҵ���������ϵ�д� �����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д�
�����̸�Ӯ����ٸ�Ч�����ܸ�ϰ���ϿƼ�������ϵ�д� �����ҵ�����������ѧ���ӳ�����ϵ�д�
�����ҵ�����������ѧ���ӳ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L�ĺ����ܱ������г���A(g)��B(g)��������Ӧ��A(g)��B(g) ![]() 2C(g)��D(s)����H��a kJ��mol��1ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ����(����)
2C(g)��D(s)����H��a kJ��mol��1ʵ�����ݺͽ���ֱ������ͼ��ʾ������˵����ȷ����(����)
ʵ�� ��� | �¶� | ��ʼ���ʵ��� | ���� �仯 | |
A | B | |||
�� | 600�� | 1 mol | 3 mol | 96 kJ |
�� | 800�� | 1.5 mol | 0.5 mol | ____ |
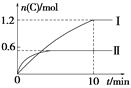
A. ʵ�����У�10 min��ƽ������v(B)��0.06 mol��L��1��min��1
B. ��������ʽ��a��160
C. 600��ʱ���÷�Ӧ��ƽ�ⳣ����0.45
D. ��ʵ������ƽ����ϵ���ٳ���0.5 mol A��1.5 mol B��A��ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2SO3��I2��H2O == H2SO4��2HI����0.1mol Cl2ͨ��100mL�������ʵ�����HI��H2SO3�Ļ����Һ������һ���HI��������������˵����ȷ����
A. ���ʵĻ�ԭ����HI��H2SO3��HCl
B. H2SO3�����ʵ���Ũ��Ϊ0.6 mol��L��1
C. ����ͨ��0.05mol Cl2��ǡ���ܽ�HI��H2SO3��ȫ����
D. ͨ��0.1mol Cl2������Ӧ�����ӷ���ʽΪ��5Cl2��4H2SO3��2I����4H2O == 4SO42����I2��10Cl����16H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��ұ������þ���õķ����ǣ� ��
A. �Ȼ�ԭ�� B. �������� C. �ȷֽⷨ D. ��ⷨ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�⻯ѧ����ʽ��ˮ�����ӷ���ʽ��ȷ���ǣ� �� ��
A. CH3COO�� + H2O![]() CH3COOH + OH�� B. NH4+ + H2O=NH4OH + H+
CH3COOH + OH�� B. NH4+ + H2O=NH4OH + H+
C. CH3COOH + NaOH![]() CH3COONa + H2O D. NaCl + H2O
CH3COONa + H2O D. NaCl + H2O![]() NaOH + HCl
NaOH + HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ѧ��ʹ����ͨ�����Ӻʹ�����ɵ����������������4����ԭ�ӹ��ɵ�������O4������˵����ȷ����
A. O4��O2��Ϊͬλ��
B. ͬ��ͬѹ�£��������O4�����O2���庬����ͬ�ķ�����
C. 18O����Ԫ�ص�һ�ֺ��أ�������������8
D. O4ת��O2Ϊ�����仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ������������У�SO2�ڽӴ����б�������ΪSO3���壬��֪�÷�ӦΪ���ȷ�Ӧ���ֽ�2 mol SO2��1 mol O2����һ�ܱ�������ַ�Ӧ�ų�����98��3 kJ����ʱ���SO2��ת����Ϊ50%���������Ȼ�ѧ����ʽ��ȷ����
A. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����196��6 kJ��mol��1
2SO3(g) ��H����196��6 kJ��mol��1
B. 2SO2(g)��O2(g)![]() 2SO3(g) ��H����98��3 kJ��mol��1
2SO3(g) ��H����98��3 kJ��mol��1
C. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����98��3 kJ��mol��1
SO3(g) ��H����98��3 kJ��mol��1
D. SO2(g)��![]() O2(g)
O2(g)![]() SO3(g) ��H����196��6 kJ��mol��1
SO3(g) ��H����196��6 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ͼ���ʾ����ϸ����Ԫ�ء������P�����ã�a��b��c��d��e������ͬ��С�������ʣ�A��B��C��E������ͬ�Ĵ�������ʣ����з�������ȷ���ǣ� ��
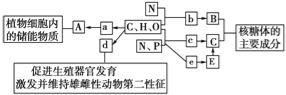
A. �ڶ���ϸ������A�������������������ԭ
B. ����d�Ļ�ѧ�����ǹ̴�
C. e��c�������ǿռ�ṹ��ͬ
D. ������ϸ��������e����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾΪ����ϸ����Ԫ�ؼ������a��b��c��d������ͬ��С�������ʣ�A��B��C������ͬ�Ĵ�������ʣ�������ش��������⡣
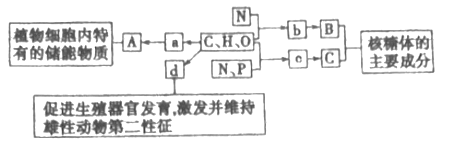
��1������a��__________���ڶ���ϸ���ڣ�������A�����������������____________��
��2������d��_________��d��_____________��ά����D�����ڹ̴������ʡ�
��3������c������ϸ���й���______�֣�����֮����ͨ��___________����ѧ�������������ģ��γ�һ��C����C����ˮ����ܵ�__________�ֻ����
��4������ϸ���к���ķֲ���ʹ�õ��Լ���___________________����ʵ���������ᴦ��ϸ���������������______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com