
【题目】在2 L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g) ![]() 2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
2C(g)+D(s) ΔH=a kJ·mol-1实验内容和结果分别如表和图所示。下列说法正确的是( )
实验 序号 | 温度 | 起始物质的量 | 热量 变化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 1.5 mol | 0.5 mol | ____ |
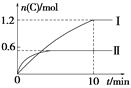
A. 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B. 上述方程式中a=160
C. 600℃时,该反应的平衡常数是0.45
D. 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
【答案】D
【解析】A、10 min时实验Ⅰ达到平衡,C的物质的量为1.2mol,所以v(C)=1.2mol÷2L÷10min=0.06 mol·L-1·min-1,根据物质的化学反应速率之比等于物质的化学计量数之比可得v(B)=v(C)/2=0.03 mol·L-1·min-1,A错误;B、实验Ⅰ中生成1.2molC时热量变化为96 kJ,则生成2molC时热量变化值为2/1.2×96 kJ=160 kJ,从平衡Ⅰ到平衡Ⅱ,温度升高,C的物质的量减小,平衡逆向移动,逆反应为吸热反应,所以正反应为放热反应,故a=-160,B错误;C、实验Ⅰ中平衡时,C的物质的量为1.2mol,浓度为0.6mol/L,A的物质的量为1mol-0.6mol=0.4mol,浓度为0.2mol/L,B的物质的量为3mol-0.6mol=2.4mol,浓度为1.2mol/L,D为固体,不计算在平衡常数中,所以K=0.62/(0.2×1.2)=1.5,C错误;D、该反应前后气体的分子数不变,温度不变时,不同情况下只要反应物的投料比例相同,就可以达到等效平衡,实验Ⅱ中充入的A和B的物质的量的比为3:1,将再充入0.5 mol A和0.5/3 mol B放入另一个容器中,两种情况可构成等效平衡, A的转化率相同,现在将再充入的0.5 mol A和0.5/3 mol B压入原容器中,相当于增压,平衡不移动,最后再将多余的1.5mol-0.5/3mol=4/3mol的B气体再压入原容器,B的农度增大,平衡正向移动,A的转化率增大,D正确。正确答案为D。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 4.0 g H218O中所含电子数为2 NA
B. 0.1 mol H2O2分子中含极性共价键数目为0.3 NA
C. 将含0.1mol FeCl3的饱和溶液滴入沸水中,形成的胶体粒子的数目为0.1NA
D. 含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某致病细菌分泌的外毒素,无色,细针状结晶,对小鼠和人体有很强的毒性,可引起流涎、呕吐、便血、痉挛等症状,以致死亡。该外毒素为环状肽,其结构简式如图所示:

请据图分析回答:
(1)该化合物中含有游离的___________个氨基,___________个羧基。
(2)该化合物是由___________个氨基酸组成的,区别这些氨基酸的种类依靠的是其结构中的___________。
(3)组成该化合物的氨基酸有_________种,其中有_______个氨基酸的R基相同,这个R基是________。
(4)该化合物为___________肽化合物,含有___________个肽键。
(5)填写虚线框内结构的名称:A.______________________, B.______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4===FeSO4+H2↑的能量变化趋势如图所示:

(1)该反应为________反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是________(填字母)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为________(填“正”或“负”)极。铜片上的现象为_______________,铜极上发生的电极反应为_____________________,
(4)外电路中电流由________极(填“铜”或“铁”下同)向______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为_______________________________________。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为_______________________________。
(5)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
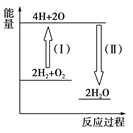
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在下列物质转化中A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外的同一种元素。请回答:
(1)A的化学式是______, Z的电子式是______。
(2)当X是强酸时,写出C→D的化学方程式:_____。
(3)当X是强碱时,写出E的稀溶液和铜反应生成C的离子方程式:_____。
II、在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (其相对分子质量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
(4)为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____(填字母代号)。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(5)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
①上表中第一次实验中记录数据明显大于后两次,其原因可能是_____(填字母代号)。
A.滴定前滴定管尖嘴无气泡,滴定结束有气泡
B.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
C.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
D.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
②通过实验数据计算的该产品纯度为_____(用字母a、c表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的性质说法正确的是
A.棉花和蛋白质都是高分子化合物,水解产物相同
B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应
C.乙酸乙酯和油脂互为同系物
D.甲烷和乙醇均能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
B. 铅蓄电池在放电过程中,负极质量增加,正极质量减少
C. 100 mL pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气多,说明HA的酸性比HB的弱
D. 已知I3-![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com